El síndrome de Hajdu-Cheney (HCS) es una enfermedad genética rara que causa acroosteólisis y osteoporosis generalizada, acompañada de una serie de trastornos esqueléticos del desarrollo y múltiples manifestaciones clínicas y radiológicas. Tiene una herencia autosómica dominante, aunque hay varios casos esporádicos no hereditarios.
- Enfermedades raras
- Hajdu-Cheney
- NOTCH2
- Tejido conectivo
1. Introducción
El síndrome de Hajdu-Cheney (HCS) es una enfermedad genética rara del tejido conectivo que pertenece al grupo de los síndromes de osteólisis. Está registrado en la base de datos del proyecto OMIM (Herencia mendeliana en el hombre) con referencia # 102500 y en ORPHANET con la referencia ORPHA955. También se conoce como displasia acro-dento-osteo, acroosteólisis con osteoporosis y cambios en el cráneo y mandíbula, artrodentoosteodisplasia y síndrome de peroné serpentino-riñón poliquístico. La prevalencia de esta enfermedad es menos de una persona en un millón (<1 / 1.000.000) y está causada por una mutación heterocigótica del gen NOTCH 2 localizado en el cromosoma 1p13-p11.El HCS sigue un patrón de herencia autosómico dominante, aunque se pueden encontrar descripciones de casos con mutaciones esporádicas.
La enfermedad fue descrita por primera vez en 1948 por N. Hajdu [6] y posteriormente completada por D. Cheney en 1965. Desde entonces, se han reportado alrededor de 50 casos de pacientes con HCS y, en general, todos los pacientes mostrar un caso de osteólisis de las falanges distales y osteoporosis generalizada, acompañada de otros trastornos, como dismorfia craneofacial y esquelética, desarrollo esquelético trastornos, pérdida prematura de dientes y baja estatura.
Debido a la variabilidad en la expresión de NOTCH2 , se pueden encontrar pacientes con diferencias fenotípicas entre ellos. Además, esta enfermedad presenta un espectro clínico amplio y específico que es raro encontrar en su totalidad en un solo paciente. Por tanto, se encuentran reportes de casos diagnosticados de HCS que presentan manifestaciones clínicas variables que empeoran con el tiempo debido a su progresión dependiente de la edad, con cambios desde la primera infancia hasta la edad adulta tardía.
2. Epidemiología
El síndrome de Hajdu-Cheney tiene una prevalencia de menos de 1 de cada 1.000.000 de nacidos vivos. Desde 1948, se han descrito aproximadamente 50 casos en todo el mundo. Es una enfermedad genética con herencia autosómica dominante, aunque se han informado casos esporádicos.
3. Etiología
Como hemos dicho anteriormente, el HCS es una enfermedad genética causada por una mutación heterocigótica de NOTCH2 . La vía de señalización NOTCH está constituida por una serie de sucesos vinculados que están íntimamente relacionados con el desarrollo esquelético y la homeostasis; por tanto, las alteraciones de esta vía provocan alteraciones en ambos procesos.
Los receptores NOTCH son proteínas transmembrana que tienen tres partes principales: un dominio extracelular que consta de múltiples repeticiones similares al EGF (factor de crecimiento epidérmico), otro dominio intermembrana y uno intracelular que consta de múltiples repeticiones de anquirina, señales de localización nuclear, y un dominio rico en prolina, ácido glutámico, serina y treonina, conocido como dominio PEST, cuya función es el reciclaje de proteínas. NOTCH tiene cuatro receptores ( NOTCH 1, 2, 3 y 4) y cinco ligandos (JAG1, JAG2 y DLL 1, 2 y 4).
La vía de señalización NOTCH se activa cuando el ligando de una célula se adhiere al receptor de la célula, provocando la separación del dominio intracelular, que viaja al núcleo de la célula donde comienza a completar su función.
En HCS, hay un truncamiento en el exón 34 de NOTCH2, lo que hace que un producto proteico no tenga el dominio PEST, lo que lleva a un nivel elevado de actividad de señalización de NOTCH en múltiples tejidos, alterando así el proceso habitual. Esto tiene un impacto notable en el desarrollo esquelético y la homeostasis, lo que conduce a la enfermedad.
Se han asociado varios trastornos con mutaciones NOTCH junto con HCS:
- CADASIL (arteriopatía cerebral autosómica dominante con infartos subcorticales y leucoencefalopatía): mutaciones de repeticiones tipo EGF de NOTCH3 .
- Válvula aórtica bicúspide: mutaciones truncadoras de proteínas de NOTCH1 .
- LAL-T: mutaciones que truncan proteínas del dominio PEST de NOTCH1 .
- Síndrome de Alagille: mutación del aceptor de empalme del exón 33 de NOTCH2 .
4. Fisiopatología
Una vez que se ha producido una mutación, el desarrollo esquelético normal se ve afectado, lo que provoca una serie de anomalías esqueléticas. Existe un déficit de densidad ósea que conduce a una displasia esquelética generalizada. La osteoporosis es uno de los signos más característicos del HCS, junto con la acroosteólisis de las falanges distales, ambas causadas por una serie de mecanismos locales que aumentan la actividad osteoclástica e impactan negativamente en la formación de hueso. Se pueden encontrar defectos congénitos en la osificación en el cartílago fetal, que provocan disostosis periférica que empeora la acroosteólisis.
La comprensión de estos procesos nos ayuda a comprender algunas de las manifestaciones clínicas que se observan en el amplio espectro de presentaciones clínicas que proporciona este síndrome: fracturas en huesos largos por desmineralización ósea, infecciones respiratorias frecuentes causadas por deformidades torácicas y restricción ventilatoria, invaginación basilar y sus alteraciones neurológicas, y baja estatura por colapso vertebral. Estas son algunas de las complicaciones clínicas que surgen de estos procesos que, cuando se consideran junto con la progresión dependiente de la edad del HCS, hacen que este síndrome sea tan complejo.
5. Manifestaciones clínicas
Este síndrome tiene tres características principales con respecto a los síntomas: un fenotipo variable, un amplio espectro de presentación clínica y una progresión dependiente de la edad. Siguiendo estos tres parámetros, algunos pacientes son diagnosticados de HCS con diferentes presentaciones clínicas y diferencias fenotípicas de persona a persona, y estas manifestaciones tienden a evolucionar con el tiempo. Las siguientes manifestaciones clínicas son las más representativas de HCS:
- Alteraciones craneales: batrocefalia, presencia de múltiples huesos wormianos, cierre de sutura retardado, domo engrosado del cráneo, ausencia de senos frontales, silla turca alargada, mandíbula pequeña, invaginación basilar, dolicocefalia y prominencia occipital.
- Alteraciones faciales: facies gruesa y dismórfica, filtrum alargado, micrognatia, orejas de implantación baja, telecanto, sinofridia, cejas tupidas, pestañas largas, nariz ancha, paladar alto arqueado, pérdida prematura de la dentadura, maloclusión mandibular, hirsutismo e hipertelorismo.
- Alteraciones musculoesqueléticas: talla baja, cuello corto, fracturas de huesos largos, laxitud articular, vértebras bicóncavas, cifoescoliosis, inestabilidad cervical, colapso vertebral, genu valgo, peroné serpentino, acroosteólisis, pseudoclubbing, dedos cortos, dedos hipocráticos, resorción ósea distal progresiva, hueso desmineralización, osteopenia y osteoporosis.
- Alteraciones cardiovasculares: cardiopatía congénita, conducto arterial permeable y defectos del tabique.
- Alteraciones digestivas: malrotación intestinal.
- Alteraciones neurológicas: hidrocefalia y meningocele lateral.
- Alteraciones renales: hipospadias, criptorquidia, quistes renales e insuficiencia renal.
- Alteraciones respiratorias: deformidades torácicas, restricción ventilatoria e infecciones recurrentes.
- Otras alteraciones: retraso en el desarrollo motor, hipoacusia, alteraciones de la voz, voz grave, uñas cortas, úlceras plantares y hernias.
Las manifestaciones clínicas más relevantes se muestran en las Figuras 1, 2, 3 y 4.
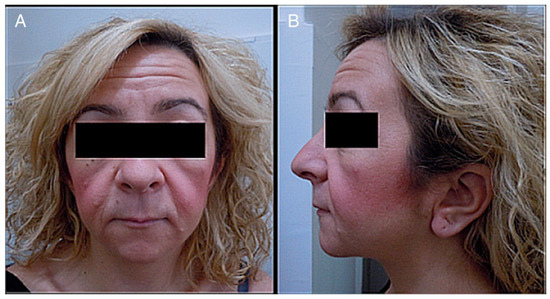
Figura 1. ( A ) Fotografía del rostro de un paciente. ( B ) Fotografía lateral de la cabeza y el rostro de un paciente. Se observa lo siguiente: cara pequeña, telecanto y fisuras palpebrales descendentes, micrognatia, boca pequeña, labios finos, surco nasolabial largo y mejillas llenas, orejas bajas con pliegue en los lóbulos, cuello corto y pelo áspero.
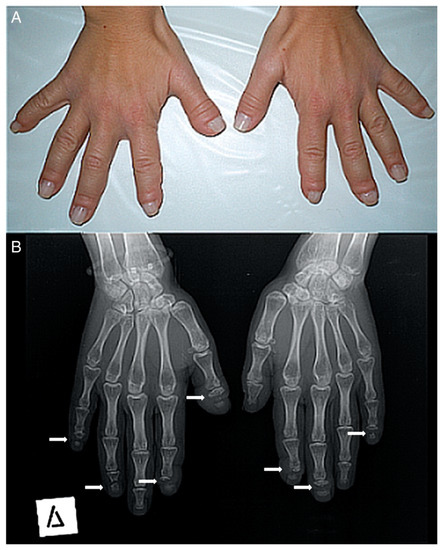
Figura 2. ( A ) Fotografía de las manos de un paciente. Muchos de sus dedos son gruesos (predominantemente el pulgar derecho) con pseudo-discotecas. ( B ) Radiografía anteroposterior de las manos de un paciente. La osteólisis de las falanges distales se encuentra en la mayoría de los dedos (solo el pulgar izquierdo, el cuarto izquierdo y el tercer dedo derecho tienen un aspecto normal). En todas las lesiones, la osteólisis tiene un patrón transversal a lo ancho de la falange terminal (flechas blancas).
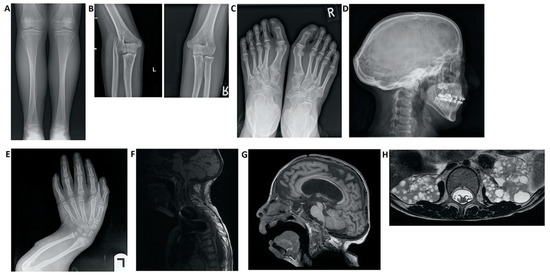
Figura 3. Hallazgos de imagen en pacientes con síndrome de Hajdu-Cheney. ( A ) Radiografía de la vista frontal de la tibia y el peroné. Observe el peroné alargado y medialmente desviado, que se superpone al hueso de la tibia, denominado "peroné serpentino". ( B ) Radiografías de la vista lateral del brazo izquierdo que muestran luxación de la cabeza radial. ( C ) Radiografía de la vista frontal de los pies que muestra hallux valgus, huesos metatarsianos apiñados, dedos distales del pie corto y signos de acroosteolisis en las falanges distales del primer dedo. ( D ) Radiografía de la vista lateral del cráneo, que demuestra batrocefalia, hipoplasia de los senos frontales y múltiples huesos de gusano occipital. ( E) Radiografía de la vista frontal de las manos, que muestra apiñamiento de los huesos metacarpianos, dedos cortos distales de la mano y signos de acroosteolisis en las falanges distales. ( E ) Radiografía de la vista lateral del brazo, que muestra acortamiento de los dedos distales y huesos largos del brazo, y un radio y cúbito curvados. ( F ) RM de columna que muestra deformaciones de la columna cervical, así como una siringe importante de la médula. ( G ) Resonancia magnética cerebral. Nótese el agrandamiento ventricular con una derivación VP (ventrículo-peritoneal), hipoplasia frontal de los senos nasales y un pequeño foramen magnum. ( H ) RM abdominal que muestra múltiples quistes renales bilaterales.
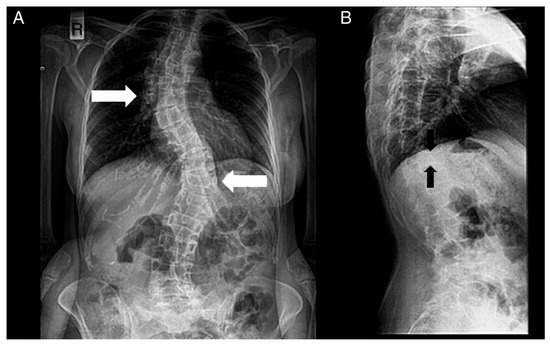
Figura 4. Radiografías de la columna de un paciente. ( A ) Vista anteroposterior. ( B ) Vista lateral. Se notan los siguientes: escoliosis (doble mayor — con una curva torácica derecha y toracolumbar izquierda — flechas blancas) y deformidades bicóncavas de la placa terminal superior e inferior (deformidad en espina de pescado — flechas negras) de muchas vértebras y disminución de la densidad ósea.
Las complicaciones clínicas más frecuentes de este síndrome son la invaginación basilar y, en consecuencia, el daño cerebral, la hidrocefalia, la siringomielia, el colapso vertebral debido a la compresión y la restricción ventilatoria causada por una deformidad torácica.
Existe un subgrupo de pacientes dentro de este síndrome que presentan dos signos distintivos: peroné serpentino y riñones poliquísticos. Inicialmente, se pensaba que los pacientes con estos signos pertenecían a una enfermedad separada, diferente de HCS, pero los estudios genéticos demostraron que ambos se originaban en el mismo gen mutado. La expresión variable de NOTCH2 justifica la asociación frecuente de peroné serpentino y riñones poliquísticos como nada más que otra manifestación de HCS y no un síndrome independiente.
En base a la progresión de este síndrome dependiente de la edad, se ha demostrado que después de monitorear varios casos a lo largo del tiempo, los fenotipos y síntomas empeoran gradualmente. Hay una serie de estadios de la enfermedad según la edad, que permiten siete divisiones generacionales:
- nacimiento (<1 año)
- primera infancia (de 1 a 5 años)
- infancia (de 6 a 12 años)
- adolescencia (13 a 19 años)
- adultez temprana (20 a 33 años)
- edad adulta media (36 a 65 años)
- adultez tardía (65+).
Destacamos la importancia de presentar un informe actualizado de la variabilidad de las manifestaciones y el fenotipo cambiante de esta enfermedad.
6. Diagnóstico
El diagnóstico de HCS se sospecha mediante la observación de la apariencia física y los hallazgos radiológicos [29], pero el diagnóstico final se llega a través de la secuenciación genética del exón 34 de NOTCH2 .
Brennan y Pauli crearon una herramienta de diagnóstico que establece los criterios de inclusión para este síndrome.
Cabe destacar la necesidad de establecer un diagnóstico diferencial con otros trastornos y síndromes que comparten manifestaciones clínicas y pueden generar incertidumbre diagnóstica.
En cuanto a su naturaleza osteolítica, el HCS se puede comparar con algunos de los trastornos que pertenecen al grupo de síndromes de osteólisis, como Torg, François, Whyte-Hemingway, Winchester, y un nuevo síndrome conocido como osteólisis Talo-patelo-escafoidea , sinovitis y cuartos metacarpianos cortos. Una de las principales características de la enfermedad a analizar es la acroosteólisis, que es un signo que también podemos encontrar en otros trastornos como la esclerodermia, sarcoidosis, trastornos neuropáticos y síndromes reumatoides. La progeria y la picnodisostosis son otro tipo de trastorno que causa acroosteolisis congénita. Incluir la enfermedad de Paget u otros síndromes de osteoporosis en el diagnóstico diferencial también es de interés por su naturaleza osteoporótica. Existen estudios sobre el diagnóstico diferencial entre HCS y meningocele lateral considerando similitudes fenotípicas y con el síndrome de Alagille debido a sus vínculos genéticos. Otros síndromes que comparten la invaginación basilar entre sus manifestaciones clínicas son la osteogénesis imperfecta, la osteocondrodisplasia congénita y la displasia espondiloepifisaria, y también podrían tenerse en cuenta al crear el diagnóstico diferencial de HCS.
7. Tratamiento
No existe un tratamiento farmacológico definitivo o eficaz para el HCS en la actualidad, y aunque se han desarrollado ciertos ensayos con bifosfonatos, no hay pruebas suficientes de su eficacia. La intervención quirúrgica como método para evitar complicaciones ha demostrado ser eficaz en determinados casos. El tratamiento actual para el HCS se basa en el manejo de complicaciones y problemas subyacentes con el fin de mejorar la calidad de vida y la esperanza de vida del paciente. Ciertos estudios consideran la manipulación de inhibidores de la gamma-secretasa como una posible forma de prevenir este trastorno.
8. Pronóstico
El HCS está clasificado como una enfermedad genética rara, pero no existen estudios que ofrezcan una perspectiva global sobre el pronóstico y la calidad de vida de los pacientes afectados. La gravedad de la enfermedad depende de los órganos afectados, las complicaciones clínicas y la evolución degenerativa de cada paciente. La osteoporosis generalizada y el desarrollo de acroosteolisis provocarán fracturas, dificultad para caminar y dependencia para las actividades de la vida diaria.
El pronóstico empeora cuando existen complicaciones como la invaginación basilar, que provocan alteraciones neurológicas o deformidades torácicas que provocan restricción ventilatoria. Debido a la baja prevalencia y la falta de información cualitativa sobre este síndrome, es difícil conocer la carga de enfermedad y los años de vida saludable perdidos. Los investigadores deben discutir los resultados y cómo se pueden interpretar los datos de los estudios previos y las hipótesis de trabajo. Los hallazgos y sus implicaciones deben discutirse en el contexto más amplio posible. También se pueden destacar las direcciones de investigación futuras.
This entry is adapted from the peer-reviewed paper 10.3390/ijerph17176174
