Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Pharmacology & Pharmacy
尽管采用了许多策略来减缓癌症的扩散,但新的抗肿瘤药物的开发和副作用的最小化一直是抗肿瘤领域的主要研究热点。天然药物是药物开发的巨大宝库,作为抗肿瘤药物在临床上得到了广泛的应用。Selaginellaceae家族的Selaginella物种在世界范围内广泛分布,并且在预防和治疗癌症的临床实践中已被充分证明。双黄酮类化合物是Selaginella的主要活性成分,它们具有良好的生物学和抗肿瘤活性,值得广泛研究。来自Selaginella(SFB)的双黄酮类化合物在癌症治疗领域的前景正在实现,这要归功于新的研究,这些研究提供了对多靶点治疗机制和关键信号通路的见解。
- Selaginella
- biflavonoids
- anticancer
1. 简介
响应许多致瘤触发因素而由局部组织细胞扩增产生的新生长被称为“肿瘤”。它主要是占据空间的肿块突起,也称为肿瘤[1,2]。就发病率和死亡率而言,癌症仍然是一个主要的全球性公共卫生问题,仅次于心血管疾病[3,4]。国际癌症研究机构2020年发布的一份全球癌症统计数据报告指出,在本世纪,癌症可能超过心血管疾病,成为大多数国家过早死亡的主要原因。到2040年,预计全球将有28万新发癌症病例,比4年增加47%[2020,5]。癌症的致病机制包括维持增殖信号、躲避生长抑制剂、避免细胞死亡、建立复制性永生性、启动血管生成以及触发侵袭和转移[6]。在过去的7年中,已经采用了许多策略来减缓癌症的扩散,即手术、放疗和全身治疗[50,8]。然而,这些治疗存在许多局限性和副作用,例如耐药和多药耐药发生率高、某些靶向治疗疗效低以及单独或联合用药均存在严重不良反应[9,10]。因此,开发新型抗肿瘤药物和尽量减少副作用一直是抗肿瘤领域的主要研究领域。
由于其多通道和多靶点的特性,源自天然产物的抗肿瘤化合物通常用于治疗晚期癌症和缓解早期癌症症状。传统医学中使用的草药是大多数天然产物的来源[12,13,14]。在过去的几十年里,天然产物一直是开发新型抗肿瘤药物的重要来源[11]。目前,临床上有超过100种天然化合物用于治疗癌症[15,16]。例如,研究表明,姜黄中的活性成分姜黄素通过促进细胞凋亡、抑制细胞增殖、阻碍肿瘤血管生成和转移以及诱导自噬来发挥抗肿瘤作用[17,18]。例如,紫杉醇通过阻断有丝分裂(影响B细胞淋巴瘤2(Bcl-2)磷酸化)、控制微管聚合、影响钙信号传导和调节microRNA表达谱来发挥其抗乳腺癌作用[19]。此外,青蒿素具有显著的抗癌功效,可在癌细胞中产生活性氧,诱导细胞周期停滞和自噬,阻断癌细胞侵袭和迁移,加速癌细胞凋亡[20]。
近年来,关于天然产物的经典抗肿瘤信号通路的文献报道很多,发现天然产物具有多个靶点和通路的优点,为天然产物作为更有前途的抗肿瘤药物提供了充分的理论依据。例如,磷酸肌醇3激酶(PI3K)信号通路是正常细胞生理代谢的关键信号通路。通过抑制这种信号通路,可以预防肿瘤生长和转移。PI3K的激活还可以帮助Akt的磷酸化,并最终共同在肿瘤进展中起关键作用[21]。例如,Yan等人[22]发现黄芩素通过抑制PI3K / Akt信号通路诱导乳腺癌细胞凋亡和自噬。除PI3K信号通路外,转录3(STAT3)信号通路的信号转导器和激活因子是癌症治疗的关键靶点之一,是与肿瘤生长直接相关的重要细胞内信号转导蛋白和转录因子[23]。Luo等人[24]发现Bavachin通过抑制STAT3活性诱导骨肉瘤细胞中的铁死亡。此外,丝裂原活化蛋白激酶(MAPK)是一种关键的细胞内信号转导系统,可控制细胞中的各种过程,包括细胞生长、增殖、分化、凋亡、粘附和迁移。这些过程对耐药性、侵袭和转移以及肿瘤发生有影响,使其成为抗肿瘤药物的潜在靶点之一[25]。
已确认700多种,Selaginellaceae家族的Selaginella属广泛分布在世界各地;特别是,它主要分布在热带和亚热带地区。据报道,这些物种具有许多生物活性,包括抗癌、抗炎、抗菌、抗病毒、抗氧化、抗衰老、降血糖和其他活性[26,27]。然而,目前对Selaginella植物的药理研究主要集中在抗肿瘤作用上。例如,来自Selaginella doederleinii的乙酸乙酯组分对A549细胞系、7721细胞系、Hela细胞系和Eca-109细胞系表现出细胞毒性作用,其中对Hela细胞系的抑制作用最强,IC50值为37.53μg/mL[28]。Li等人[29]发现来自Selaginella doederleinii的乙酸乙酯提取物通过PI3K-Akt-mTOR和AMPKα信号通路诱导结直肠癌细胞的自噬死亡和凋亡。Lei J等人[30]发现,来自莫伦多菲链球菌的双黄酮类提取物对HCT-116细胞系和HeLa细胞系的生长速率表现出明显的负面影响,范围为0μg/mL至500μg/mL。秦等[31]用脯氨酸-乳酸制备双黄酮提取物,对肿瘤A549细胞、sw1990细胞和HepG2细胞具有显著的抑制活性。因此,本文全面讨论了双黄酮类化合物,它是发挥抗肿瘤作用的主要活性成分,并致力于阐明其抗肿瘤作用机制和信号通路。如图1所示。
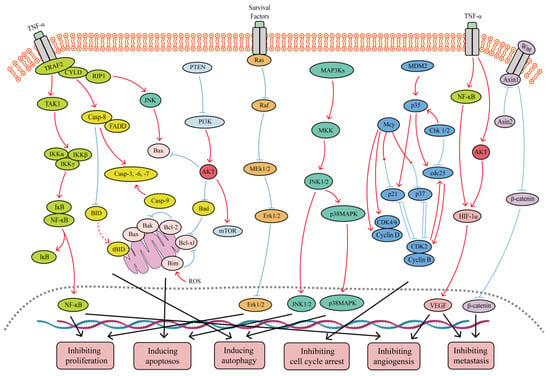
图1.SFB抗癌作用中涉及的主要信号通路。SFB可以抑制TNF-α / NF-κB,PI3K / Akt,Wnt / β-catenin,Ras / MEK / Erk和PI3K / Akt / mTOR信号通路。此外,SFB可以激活JNK1 / 2,p38 MAPK和线粒体介导的半胱天冬酶依赖性凋亡信号通路。红色曲线表示抑制,蓝色箭头表示这些过程的激活。
在过去的二十年中,科学家发现Selaginella植物具有广泛的活性成分,主要分类为生物碱,Selaginellins和酚酸。已发现Selaginellin组分由于其独特的三键结构而具有潜在的抗肿瘤活性。例如,Zhang等人[32]从柽柳Selaginella中分离出五种血清素衍生物,其中两种新的血清素通过光谱分析进行了结构表征。细胞毒性活性评估显示,两种新的血清素对人癌细胞系(U251,HeLa,MCF-7)表现出中等毒性。此外,Thamnarak 等人 [33] 分离出两种新的正木脂素硫芥醇 (1-2) 和七种已知化合物阿加他树脂醇 (3)、丁香树脂醇-葡萄糖苷 (4)、来自 Selaginella siamensis 的去甲糖素 (5)、8-甲基丁香糖醇 (6)、美拉色酮 (7)、优西诺苷 A (8) 和多科斯特罗 (9)。其中,化合物1-2对MOLT-3细胞表现出中等抑制作用,而化合物6-8对2种肿瘤细胞(HepG549、A1和HuCCA-<>)表现出中等抑制作用。
2. 双黄酮类链霉的结构特征
双黄酮类化合物是Selaginella植物的主要活性成分,具有抗癌作用[26]。SFB种通过抑制癌细胞增殖、诱导癌细胞凋亡、抑制肿瘤转移和血管生成、诱导自噬、影响肿瘤微环境等方式发挥抗肿瘤作用。如图2所示。SFB已被证明对多种肿瘤具有抗癌作用,包括卵巢癌,肺癌,前列腺癌,乳腺癌和消化系统肿瘤。
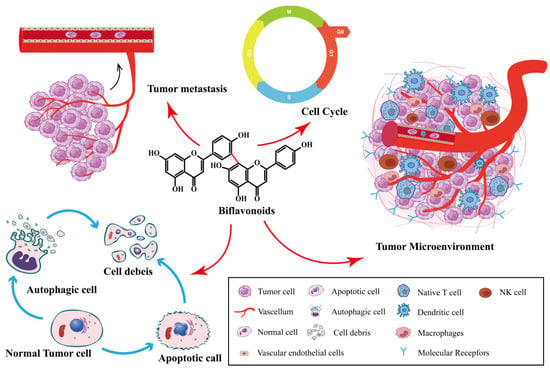
Figure 2. Synopsis of the mechanisms of SFB action against tumor cells.
Biflavonoids, a unique class of flavonoids, are primarily soluble in ethyl acetate. Their basic structural unit is made up of two molecules of flavonoids, generally in accordance with a C–C or C–O–C link. Currently, 71 different types of biflavonoids have been discovered in Selaginella plants [34]. They can be divided into five categories based on the various connection methods. As shown in Figure 3: ① amentoflavone-type (C′3-C″8)(I), of which there are 24 species, mainly represented by amentoflavone and isoginkgetin; ② robustaflavone-type (C′3-C″6)(II), with 23 species, mainly represented by robustaflavone; ③ hinokiflavone-t (C′4-O-C″6)(III), with ten species, mainly represented by hinokiflavone and isocryptomerin; ④ delicaflavone-type (C3-O-C4‴)(IV), of which there are four species, mainly represented by delicaflavone; and ⑤ biphenylether-type (C′3-O-C‴4)(V), of which there are two species.
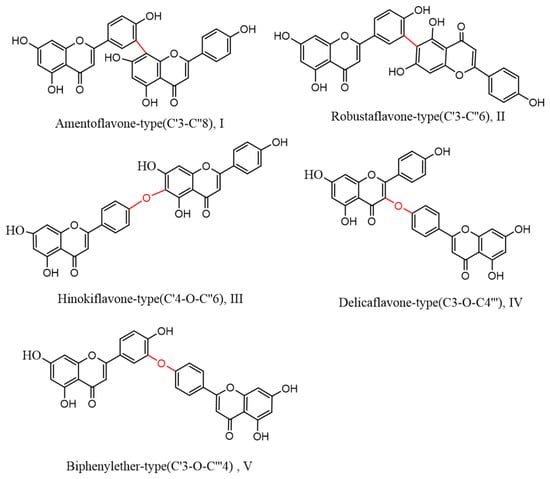
Figure 3. Biflavonoid structure types from the genus Selaginella.
Over the past 5 years, scientists have discovered numerous novel biflavonoids in Selaginella plants [35]. Nine species of bioflavonoids from Selaginella doederleinii have been recently discovered [29,30,31]. As shown in Figure 4. Among these, compound 2 [36] showed modest selectivity to A549 cells and MCF-7 cells; compound 4 [37] demonstrated potent cytotoxicity against the human cancer cell lines SMMC-7721, A549, and MCF-7; and compounds 6–9 [38] considerably inhibited the proliferation of non-small cell lung cancer. The most active compound, 9, caused apoptosis and cycle arrest in A549 cells. A new robustaflavone, (2S, 2′S)-2,3,2′,3′-tetrahydrorobustaflavone 7,4′,4‴-trimethyl ether (10), was isolated from a 75% ethanolic aqueous extract of Selaginella uncinate [39]. Selaginella trichoclada was extracted with 70% ethanol, and five novel biflavonoids were discovered. Among them, compounds 11 and 12 [40] demonstrated moderate cytotoxicity to human cancer cell lines A549 and HepG2; compound 13 [41] was effective against breast cancer via the mitochondrial pathway; compound 14 [42] demonstrated moderate cytotoxicity to human cancer cell lines DU145, MCF-7, and PC3; and compound 15 [43] showed cytotoxicity to the human breast cancer cell line MCF-7. A new biflavonoid (16) was isolated from a 70% ethanolic extract of Selaginella braunii, which showed significant antiproliferative effects on SMMC-7721, MCF-7, and A549 cells [44]. From Selaginella siamensis and Selaginella bryopteris, three novel biflavonoids known as siamamenflavones A–C (17–19) were isolated. One of them, siamamenflavone B (18), exhibited potent inhibition of wild-type EGFR protein [45]. Selaginella tamariscina yielded three novel biflavonoids: involvenflavone G (20), H (21), and I (22); H and I may have potent hypoglycemic effects [46].
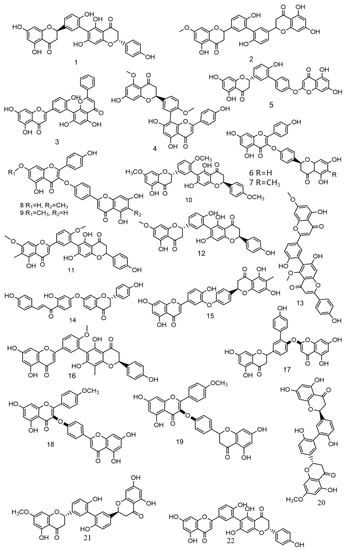
图4.最近发现了来自Selaginella doederleinii的九种生物类黄酮。
来自Selaginella属以外的植物的双黄酮类化合物也具有显着的抗肿瘤作用。据报道,抑制Eg5可引起细胞凋亡和有丝分裂停滞。因此,Eg5抑制剂正成为抗癌药物研究的焦点。作为有丝分裂驱动蛋白Eg5抑制剂,藤黄黄酮与Eg5的可变位点结合,从而抑制Eg5的ATP酶活性和运动功能[47]。从Stellera chamaejasme L.根中分离的Chamaejasmenin抑制了2种人实体瘤细胞系(HepG7721,SMMC-549,A63,MG2,U-116 OS和KHOS,HCT-48和HeLa)的细胞增殖[49]。Japoflavone D是一种来自粳花蕾的双黄酮类化合物,具有显着的抗氧化活性,在各种氧化情况下对肝癌细胞的凋亡具有双重调节作用[<>]。
This entry is adapted from the peer-reviewed paper 10.3390/ijms24097731
This entry is offline, you can click here to edit this entry!
