Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Gastroenterology & Hepatology
研究者らは、成長因子、サイトカイン、ホルモン、神経伝達物質、および局所ホルモン(オータコイド)が、in vitro初代培養肝細胞を使用して肝実質細胞(すなわち肝細胞)の増殖を促進するかどうかを研究しました。この目的で使用される指標には、DNA合成活性、核番号、細胞数、細胞周期、および遺伝子発現の変化が含まれます。さらに、原形質膜受容体から核への細胞内シグナル伝達経路について、肝細胞のDNA合成と細胞増殖を促進する代表的な増殖促進因子について詳細に調べています。
- cytokine
- growth factor
- hepatocyte proliferation
- direct mitogen
- indirect mitogen
- co-mitogen
- autocrine mechanism
- signaling pathway
1. イントロダクション
肝臓は代謝の中心器官であり、炭水化物、タンパク質、脂質、およびその他の物質を代謝することによって体の恒常性に関与しています。さらに、解毒と再生は肝臓の特徴的な機能です。これらの能力は、食物毒素(有毒化学物質)によって引き起こされる肝臓組織への壊滅的な損傷から動物を保護するために、長い進化の過程で獲得されたと考えられています[1]。
肝再生のメカニズムは長年にわたって研究されており、数多くの報告が発表されています。これらの結果を統合した優れたレビュー記事もあります[1,2,3,4,5,6]。げっ歯類肝臓の70%肝部分切除術(PHx)は、肝再生の研究モデルとして広く使用されています。たとえば、麻酔をかけたラットの肝臓の約70%を外科的に切除すると、残りの肝臓は自発的かつ迅速に細胞分裂と増殖を開始し、元の臓器の体積と重量に再生し、この応答は自動的に終了します[1,2]。この動物モデルでは、細胞増殖の開始の唯一のシグナルは局所的な損傷と組織の喪失であり、これはウイルス感染または化学物質誘発性肝障害からの肝再生のモデルよりも単純な実験システムになります。しかし、in vivo実験系は、1つの事象に多くの要因が関与しているため、PHx後の肝再生の詳細なメカニズムを調べることは本質的に困難です。
したがって、研究者らは、より単純なin vitro初代培養肝細胞システムを使用して、個々の肝細胞成長因子(および候補物質)とその細胞内シグナル伝達経路の作用を調べました。初代培養肝細胞は、生体内と同等の代謝活性を保持し、多くの種類の受容体を発現しており、それぞれがアゴニストに応答することが知られています[3,7]。また、肝組織を構成する実質細胞(肝細胞)と非実質細胞(クプファー、ピット、星状、内皮など)の細胞のうち、肝細胞が最も早い段階で増殖を開始することも知られています。
2. 肝細胞増殖調節因子の分類と特徴
マイトジェンは、EGF、TGF-α、HGF、血小板由来増殖因子(PDGF)、IGF-Iなど、それ自体で肝細胞の増殖を促進する因子として定義することができる。コマイトジェンは、それ自体では肝細胞の増殖を促進しませんが、マイトジェンと組み合わせて使用 すると、コマイトジェンはマイトジェンの活性を増強し、これらにはアドレナリン作動性αおよびβアゴニストおよびグルカゴンが含まれます。さらに、TNF-α、IL-1β、プロスタグランジン(PG)Eなどの多くの間接マイトジェンがあります。2、5-HT、およびGHは、自己分泌因子を分泌することによって肝細胞の増殖を間接的に促進する。対照的に、形質転換成長因子-β1(TGF-β1)やグルココルチコイドなどのいくつかの因子は、マイトジェン誘導肝細胞の増殖を強力に抑制します(すなわち、それらは抑制因子です)。
2.1 マイトジェン
2.1.1 直接マイトジェン
ティッカー
EGFは分子量約6kDaのタンパク質で、3つのジスルフィド結合を持っています。EGFはEGF受容体(EGFR)に結合し、受容体チロシンキナーゼ(RTK)をリン酸化することによって細胞内シグナル伝達経路を活性化します。EGF受容体は、PHxの30〜60分後にin vivoでリン酸化されます[3]。
肝細胞に対するEGFの増殖効果は、培養で調べられています。その結果、EGF単独ではDNA合成と肝細胞の増殖が促進されることが示されています。RTK、細胞外シグナル調節キナーゼ(ERK)、およびラパマイシンの哺乳類標的(mTOR)がシグナル伝達に関与していることが示唆されています[13]。ノルアドレナリンとアドレナリン作動性β2受容体アゴニストは、それ自体では肝細胞の増殖を促進しないが、これらの薬剤はEGFの増殖促進効果を高める。したがって、アドレナリン作動性β間にクロストークがあります2受容体媒介シグナル伝達系およびEGF受容体媒介シグナル伝達系(図1)。
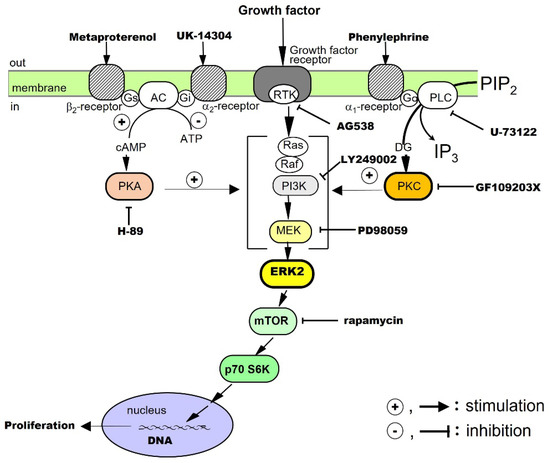
図 1.成長因子によって刺激される肝細胞増殖に対するαおよびβアドレナリン受容体アゴニストの共分裂促進効果。
TGF-α
TGF-αは分子量約5.5 kDaのタンパク質で、EGFと高いアミノ酸相同性を持ち、EGFR/ErbB1に結合します。受容体二量体化後、TGF-αはRTKを活性化し、RTKは次に、細胞内シグナル伝達のためにアダプタータンパク質であるSmadを介してマイトジェン活性化タンパク質(MAP)キナーゼカスケードを活性化します[35]。ケラチノサイトやさまざまな癌細胞によって産生されるサイトカインであるTGF-αは、培養中の肝細胞単独のDNA合成と増殖を直接促進します[19]。また、いくつかのサイトカインに応答して肝細胞によって分泌される自己分泌因子でもあります(以下を参照)。
肝細胞に対するTGF-αの効果は、培養において調査されています。その結果、TGF-α単独ではDNA合成と肝細胞の増殖が促進され、RTK、ホスファチジルイノシトール-3キナーゼ(PI3K)、ERK、およびmTORがそのシグナル伝達に関与していることが示されています。さらに、アドレナリン作動性α1受容体アゴニストはTGF-αの効果を増強し、アドレナリン作動性αとのクロストークを示唆している1受容体媒介性シグナル伝達経路(図1)。
ティッカー
HGFは、728個のアミノ酸とヘテロ二量体構造からなるタンパク質で、重鎖は約60 kDa、軽鎖は約3.5 kDaです。肝臓の星細胞や内皮細胞が産生するサイトカインです。その受容体はcMetであり、細胞内ドメインのRTKを二量体化および活性化してHGFの作用を媒介します[36,37,38]。
肝細胞に対するHGFの増殖効果は、培養において調べられている。結果は、HGFのみがDNA合成と肝細胞の増殖を促進し、RTK、PI3K、ERK、およびmTORがそのシグナル伝達に関与していることを示しています[20]。我々はまた、アドレナリン作動性α1およびβ2受容体アゴニストは、クロストークによってHGFの成長促進効果を増強します(図1)。
PDGF
PDGF belongs to the PDGF/VEGF family. Its molecular weight is approximately 30 kDa, and its A and B chains form homo- and hetero-dimeric structures (PDGF-AA, PDGF-BB, and PDGF-AB), which activate RTK for intracellular signal transduction [39]. It was first isolated from platelets, but it is also produced by macrophages, vascular endothelial cells, smooth muscle cells, and cancer cells. In addition to PDGF, the platelets also contain TGF-β1, HGF, and 5-HT, which are released during the platelet adhesion and aggregation associated with tissue injury [3]. The released PDGF is thought to trigger a series of responses including inflammation and macrophage, neutrophil, and fibroblast migration.
We investigated the proliferative effects of PDGF on hepatocytes in culture. The results showed that PDGF-BB alone promotes DNA synthesis and proliferation of hepatocytes and that RTK, PI3K, ERK, and mTOR are involved in its signal transduction [21]. In addition, an adrenergic α1 receptor agonist enhances the effects of the PDGF-BB, suggesting crosstalk with adrenergic α1 receptor-mediated signaling pathways (Figure 1).
Insulin
Human insulin is a heterodimer consisting of an A chain of 21 amino acids and a B chain of 30 amino acids, joined by two disulfide bonds. It is produced by pancreatic B cells and can always act on the liver via the portal bloodstream. The receptor for insulin is a built-in tyrosine kinase, and its activation phosphorylates its intracellular substrate, insulin receptor substrate-1 (IRS-1). Subsequently, signals are transmitted to PI3K and protein kinase B, and glucose transporter-4 is translocated to the cell surface. It has also been reported that blood levels of insulin increase soon after PHx [40].
The proliferative effect of insulin on hepatocytes has been said to be a co-mitogen that enhances the action of direct mitogens such as EGF. Therefore, we investigated the effects of insulin in culture. Our results showed that insulin alone promotes DNA synthesis and hepatocyte proliferation and that RTK, PI3K, ERK, and mTOR are involved in its signaling [22,41]. In addition, an adrenergic α1 receptor agonist potentiates the action of insulin, suggesting crosstalk with adrenergic α1 receptor-mediated signaling pathways (Figure 1).
2.1.2. Co-Mitogens
Noradrenaline
Noradrenaline is a sympathetic neurotransmitter with a catecholamine structure. Noradrenaline receptors include adrenergic α and β types, each of which has subtypes. All the receptors for noradrenaline are G-protein-coupled ones. It has been reported that sympathetic hyperactivity due to post-PHx invasion increases the blood levels of noradrenaline in about 1 h [42]. It activates the duodenal Brunner’s gland and stimulates EGF production and HGF expression [43,44].
In primary cultured hepatocytes, noradrenaline alone does not promote the proliferation of hepatocytes, but, through crosstalk, it can enhance the hepatocyte proliferation-promoting effects of EGF [13], TGF-α [19], HGF [20], PDGF [21], and insulin [22] (Figure 1). In addition, in combination with phenylephrine (a selective adrenergic α1-receptor agonist), it enhances the hepatocyte-proliferative effects of EGF, HGF, TGF-α, PDGF, and insulin. Metaproterenol (a selective β2-receptor agonist) enhances the proliferative action of EGF, IGF-I, and HGF. These results show that noradrenaline exhibits unique regulatory mechanisms for these growth factors.
2.1.3. Indirect Mitogens
IL-1β
IL-1β was the first inflammatory cytokine among the ILs to be identified, and there are two types, IL-1α and IL-1β [45]. IL-1β is a protein consisting of 110–140 amino acids. IL-1 receptors are highly homologous to toll-like receptors and activate serine/threonine kinases via adaptor proteins for intracellular signal transduction. IL-1 is rarely detected in normal tissues and is produced and secreted by macrophages and other immune cells activated by infiltrating inflammation. It has proliferative effects on monocytes and granulocytes.
The proliferative effects of IL-1β on hepatocytes have been examined in culture. The results have shown that IL-1β alone promotes DNA synthesis and the proliferation of hepatocytes and that the IL-1β effects are mediated via autocrine secretion of TGF-α from hepatocytes (Figure 2) [24]. IL-1α does not promote the proliferation of hepatocytes.
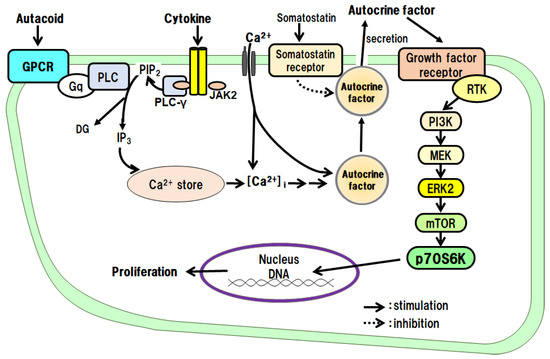
Figure 2. Hepatocyte proliferative effects of autacoids and growth hormone via an autocrine mechanism.
TNF-α
TNF-α is a protein consisting of 157 amino acids and is a potent proinflammatory cytokine similar to IL-1 and IL-6. TNF-α promotes the proliferation of hepatocytes via TNF-α type 1 receptors [46]. The major TNF-α-producing cells in peripheral tissues are macrophages (Kupffer cells in the liver), but it is also released from mast cells. It is involved in the pathogenesis of chronic inflammatory diseases such as Crohn’s disease and rheumatoid arthritis.
We investigated the proliferative effects of TNF-α on hepatocytes in culture. The results showed that TNF-α alone promotes DNA synthesis and the proliferation of hepatocytes and that its effects are mediated via its autocrine secretion of TGF-α from the hepatocytes (Figure 2) [25].
PGE2 and Prostacyclin (PGI2)
Prostaglandins (PGs) are low-molecular-weight local hormones. The receptors for PGs include EP, IP, and TP types, all of which are G protein-coupled. PGs are synthesized under the influence of cyclooxygenase (COX) from arachidonic acid and excised from the plasma membrane by phospholipase A2. The physiological process involves constitutive COX-1 expression, while the inflammatory process involves inducible COX-2 expression. Biosynthesized PG products exhibit a variety of physiological effects, but inactivation is relatively rapid. PGs act on cells of the immune system to enhance inflammatory responses (redness, fever, swelling, pain, and dysfunction) by promoting the release of IL-1 and TNF-α. PGI2 is produced by vascular endothelial cells, regulates blood flow, and inhibits platelet aggregation. It has been reported that PGs stimulate hepatocyte DNA synthesis in culture [47].
In primary cultured hepatocytes, we investigated the intracellular signaling pathways of PGE2 and PGI2, which promote DNA synthesis and the proliferation of hepatocytes. As a result, we found that both PGE2 and PGI2 indirectly promote DNA synthesis and the proliferation of hepatocytes via the secretion of the autocrine factor TGF-α from the hepatocytes (Figure 2) [39,40,48].
5-HT
5-HT is a low-molecular-weight substance with receptor subtypes designated 5-HT1 to 5-HT7. 5-HT acts as a neurotransmitter in the central nervous system and as a messenger molecule in the periphery. For example, it is released from enterochromaffin (EC) cells in the small intestinal epithelium and acts as a local hormone. 5-HT is stored in platelets and released upon stimulation and is involved in blood coagulation by promoting platelet aggregate formation (hemostatic thrombus). 5-HT has been reported to be involved in the promotion of liver regeneration [49]. That is, thrombocytopenic mice have impaired liver regeneration, and the administration of 5-HT restores liver regeneration. However, since platelets also contain other mediators (PDGF, HGF, etc.) that promote hepatocyte proliferation, it is necessary to examine whether this is a direct or indirect action of 5-HT.
When we examined the direct action of 5-HT on the proliferation of hepatocytes in culture, we found that 5-HT promotes the autocrine secretion of TGF-α from the hepatocytes via the 5-HT2B/Gq/phosphoinositide-specific phospholipase C (PLC)/Ca2+ pathway. We then found that the secreted TGF-α directly promotes DNA synthesis and hepatocyte proliferation (Figure 2) [14,17,18].
GH
GH is a single-chain peptide consisting of 191 amino acids, which is secreted from the anterior pituitary gland. GH induces functional changes in the metabolic capacities of various organs, such as the growth and differentiation of cells and tissues, bone mineralization, and the metabolism of carbohydrates, lipids, and proteins [28]. Its receptor is a Janus kinase 2 (JAK2)-related type. In vivo, GH is known to promote liver regeneration in PHx rats [50].
We examined the effects of GH on the proliferation of hepatocytes and intracellular signaling pathways in culture. GH promotes the autocrine secretion of IGF-I from the hepatocytes via the GH receptor/JAK2/PLC/Ca2+ pathway. We then found that the secreted IGF-I directly promotes DNA synthesis and hepatocyte proliferation (Figure 2) [15,16,23].
This entry is adapted from the peer-reviewed paper 10.3390/cells12020208
This entry is offline, you can click here to edit this entry!
