Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Food Science & Technology
茶多糖(TPS)是茶叶中仅次于茶多酚的第二丰富成分。作为一种复合多糖,TPS具有复杂的化学结构和多种生物活性,如抗氧化、降血糖、降血脂、免疫调节、抗肿瘤等。此外,在食品、化妆品、医药保健品等方面也显示出良好的开发和应用前景。茶叶、花和种子是茶多糖提取材料的三大主要来源。TPS的生产工艺主要有热水提取、超声波辅助提取、微波辅助提取、酶解提取等。
- tea
- polysaccharides
- extraction method
一、简介
目前TPS的生产工艺主要有热水提取、超声波辅助提取、微波辅助提取、酶解提取(表1)。其常规制备工艺如图1所示。
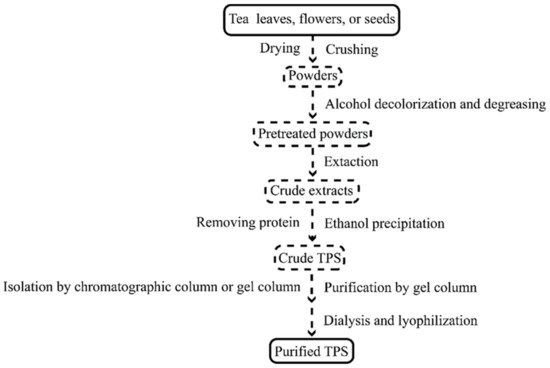
图 1. TPS 制备的常规过程。
表 1茶多糖(TPS)提取方法比较
| 提取方法 | TPS 起源 | 提取步骤 | 参考 |
|---|---|---|---|
| 热水提取 | 绿茶叶和花 | 95%乙醇40℃预提取2 h,重复3次;60℃水浴萃取2小时,重复3次 | [ 14 ] |
| 福安白茶、平阳特早茶 | 80 °C 萃取 1.5 h,重复 2 次 | [ 15 ] | |
| 茯砖茶 | 提取时间2 h,料液比1:20,提取温度95 ℃;重复三遍 | [ 10 ] | |
| 白茶 | 提取时间8 min,提取温度54.1 ℃,料水比12.48 L/g;重复四次 | [ 16 ] | |
| 绿茶 | 在 90°C 的水浴中加热 2 小时并持续搅拌 | [ 17 ] | |
| 绿茶 | 无水乙醇预萃取 24 h,去离子水 60 °C 萃取 90 min | [ 18 ] | |
| 钦砖茶 | 80% 乙醇预处理并用蒸馏水 (1:20, w / v ) 在 90 °C 下连续搅拌 2 h | [ 19 ] | |
| 六泡茶 | 80%乙醇预处理24 h,去离子水70℃萃取2 h;重复三遍 | [ 20 ] | |
| 茶花 | 90 °C 萃取 1 小时(2 次) | [ 21 ] | |
| 绿茶 | 80%乙醇70℃预处理1.5小时,40℃乙醇提取3小时 | [ 22 ] | |
| 绿茶 | 2倍体积95%乙醇50℃预处理4h,料液比1:8,50℃搅拌萃取120min | [ 23 ] | |
| 绿茶 | 用 95% 酒精(1:5,w / v )预处理 2 小时,在 80°C的热水(1:10, w / v )中萃取;重复3次,每次1小时 | [ 24 ] | |
| 绿茶 | 95% 乙醇(1:6,w / v)在 60°C 预处理 4 小时,用蒸馏水(1:10,w / v)在 80°C 提取 4 小时;重复3次 | [ 25 ] | |
| 祁门红茶 | 用 95% 乙醇(1:6,w / v)在 80°C 预处理 2h,然后浸入 80°C 蒸馏水(1:10,w / v)中 4h;重复四次 | [ 26 ] | |
| 超声辅助提取 | 低档绿茶 | 提取温度 80 °C,提取时间 60 min,超声波功率 400 W,液固比 22 mL:g | [ 27 ] |
| 粗茶 | 在超声波浴(50 °C,200 W)中预处理 30 分钟,然后在水浴中提取 90 分钟;重复三遍 | [ 23 ] | |
| 绿茶花 | 超声波功率(25 °C、100、150、200、250 和 300 W)萃取 5 分钟;重复2次 | [ 21 ] | |
| 黄茶 | 95% 乙醇预处理 6 h,90 °C 水浴萃取 55 min(重复两次),超声处理(20 kHz,500 W)55 min | [ 21 ] | |
| 微波辅助萃取 | 绿茶、红茶和乌龙茶 | 1:20 固液比,200–230 °C 提取温度,2 分钟提取时间 | [ 28 ] |
| 绿茶花 | 在受控微波功率下萃取 5 分钟,然后在相同微波功率下用蒸馏水萃取 5 分钟 | [ 21 ] | |
| 绿茶 | 600W微波仪器萃取30min,水浴搅拌90min;重复三遍 | [ 29 ] | |
| 酶解提取 | 绿茶 | 100℃萃取3小时,果胶酶和鞣酸酶水萃取35℃2小时 | [ 30 ] |
| 绿茶 | 用复合酶(纤维素酶:果胶酶:葡聚糖酶 = 1:1:2)在 50°C 提取 30 分钟,在 90°C 沸腾 10 分钟,然后在 50°C 水浴中提取 80 分钟 | [ 29 ] | |
| 绿茶叶和花 | 95%乙醇40℃预处理2h(重复3次),0.5%(m/v)戊聚糖复合酶溶液(45℃,pH 5.5)处理2h,45℃水浴萃取2小时 | [ 14 ] | |
| 绿茶 | 在90℃水浴中加热2-4小时,重复两次;与 0.5% 果胶酶 (260,001 PGU/mL, v / w ) 在 40 °C 下孵育 30 分钟;并在 90°C 下加热 1 小时以使酶失活 | [ 31 ] | |
| 水/溶剂热萃取 | 中国茶中茶108 | 120 °C 萃取 1 小时 | [ 1 ] |
| 碱辅助萃取 | 福砖砖茶 | 在 60 °C 下用 0.1 M NaOH 溶液 (pH = 10.0) 萃取,重复 3 次 | [ 32 ] |
| 超临界流体萃取 | 绿茶 | 380 μm 粒径,20% 无水乙醇,35 MPa 提取压力,45 °C 提取温度,2 h 提取时间 | [ 33 ] |
| 阴离子反胶束萃取 | 绿茶 | pH = 4.6、0.06 M 盐酸胍、7% 甲醇和 0.05 M NaCl;前向提取 | [ 34 ] |
2.热水提取
大多数生物活性多糖是极性的,因此通常使用热水或碱性溶液等极性溶剂提取多糖 [ 33 ]。热水提取是食品、医药等行业广泛用于制备多糖的经典方法[ 34 ]。Chen 等人使用水浴加热(70 ℃,60 分钟)从黑茶、乌龙茶和绿茶叶中提取三种粗制 TPS [ 35 ]。Xu 等人在 70°C 的热水中用 3 次普洱茶制备 TPS,每次 180 分钟 [ 36 ]。范等人在福安白茶和平阳特早茶中加入双蒸水,在 80 ℃水浴中加热 1.5 小时,两次提取 TPS [ 37]。朱等人利用响应面法对茯砖茶粗多糖(CDTPS)的提取工艺进行了探索,发现最佳提取条件(重复4次)为:提取时间为2 h,固液比例为 1:20,萃取温度为 95 °C。在此条件下,CDTPS 的收率为 6.07% [ 10 ]。Jin等人采用响应面法,通过重复4次在白茶中预测TPS的最佳提取条件:最佳提取时间为97.8 min,提取温度为54.1 ℃,料水比为12.48升/克 [ 14]。Wang 等人将干燥的绿茶叶和花在 95% 乙醇和 40°C 中预处理 2 小时,然后重复该过程 3 次以去除色素和其他物质。然后,将 2 L 蒸馏水加入过滤后的茶样品中,在 60 ℃水浴中提取 2 h。过滤后,加入 2.5 L 蒸馏水,再次重复热水萃取(60 ℃,2 h)[ 38 ]。类似地,Cai 等人用无水乙醇预处理绿茶叶 24 小时以去除一些小分子色素和多酚,然后用去离子水在 60°C 下将茶叶样品干燥 90 分钟 [ 16 ]。Li 等人也用 80% 乙醇预处理了金砖茶粉,离心后用蒸馏水(1:20,w/ v ) 在 90 °C 下 2 小时以提取 TPS [ 17 ]。秦等人用 80% 乙醇预处理六泡茶样品 24 小时。过滤和干燥后,样品用去离子水在 70°C 下萃取 2 小时,该过程重复 3 次 [ 18 ]。Wei 等人对干茶花多糖 (TFPS) 进行热水提取,然后用蒸馏水提取 TFPS 两次(每次 1 小时)。他们发现TFPS的得率随着提取温度的增加而增加,90℃是TFPS的最佳提取温度。此条件下的收率接近 35% [ 19]。虽然热水提取是TPS提取的常用方法,但传统的热水提取存在提取效率低、提取时间长、提取温度高等缺点,限制了其可用性[ 33、39 ]。例如,Wang 等人进一步比较了 TFPS 的热水提取、沸水提取和酶解提取的得率,他们发现酶解提取的 TFPS 的得率最高(2.01%),其次是煮沸。水萃取 (1.91%),最后是热水萃取 (1.83%) [ 20]。朱等人比较了热水提取(WE)、酶促提取(EE)、微波辅助提取(MAE)和超声辅助提取(UAE)三种粗绿茶多糖(CTPSs)的得率,他们发现:这些提取方法下 CTPS 的四种收率分别为 3.98%、4.17%、4.31% 和 4.52% [ 21]。大量研究证实,虽然热水提取具有很强的实用性,但其获得的TPS收率较低,容易造成不必要的原料浪费。因此,许多研究人员还在热水提取的基础上改进了该技术,并开发了其他辅助提取方法,如超声波辅助提取、微波辅助提取、酶辅助提取等,以提高 TPS 的提取效率 [ 40 ]。
3. 超声波辅助萃取 (UAE)
阿拉伯联合酋长国可以通过高频超声振动引起的样品中分子的高速运动,加速植物细胞壁的破裂,从而溶解和释放细胞内物质。Karadag 等人利用阿联酋提取低品位绿茶多糖 (GTPSs),然后通过响应面优化报告了最佳提取参数如下:提取温度 80 ℃,提取时间 60 分钟,超声波功率 400 W , 和 22 mL/g 的液固比。在此条件下,GTPS 的收率为 4.65%,高于无超声波的热水提取法(1.83%)[ 25]。此外,他们还发现,超声辅助提取得到的 GTPS 的 Mw 较低,这可能是由于超声过程导致 TPS 部分降解所致。朱等人用粗绿茶叶制备TPS,将茶叶置于超声波浴(50℃,200W)中预处理30分钟,然后在水浴中提取90分钟。用这种方法获得的 TPS 产量高于其他测试方法 [ 21]。为了探索超声对黄茶多糖 (YTPS) 结构和活性的影响,Wang 等人用超声 (20 kHz, 500 W) 处理热水提取和脱蛋白后获得的 YTPS 馏分 55 分钟。结果表明,超声波处理基本没有改变 YTPS 的主要化学成分,但确实导致其降解 [ 26 ]。Wei 等人将干燥的绿茶花块与蒸馏水混合,在 100、150、200、250 和 300 W 的超声波功率下,在 25°C 下提取 5 分钟。此过程重复两次以获得粗 TFPS [ 19]。总体而言,UAE方法具有省时、操作简单、实验安全、成本低、提取率高等优点。尽管如此,它可能会降解可溶性 TPS 并影响其生物活性。
4. 微波辅助萃取 (MAE)
近年来,微波辅助提取(MAE)技术已广泛用于分析和提取植物中的活性成分。MAE是一种利用高频电磁波(0.3-300 GHZ)具有强穿透性和加热效应的提取植物活性成分的新型提取技术。高能微波可以穿透溶剂和植物细胞壁,将能量传递到细胞质,并与极性成分相互作用产生热量,从而提高细胞内的温度和压力。当压力达到一定水平时,细胞壁膨胀破裂,释放出胞内多糖等物质[ 41]。Shuntaro 等人使用 MAE 技术从茶渣(绿茶、红茶和乌龙茶)中提取 TPS。当提取条件为料液比为 1:20、提取温度为 200~230 ℃、提取时间为 2 min 时,茶渣 TPS 的得率为 40~50% [ 27 ]。Wei 等人使用 MAE 设备提取 TFPS 两次,每次 5 分钟。他们发现,随着微波功率的增加,TFPS 的产量发生了不规则的变化。此外,随着微波功率的增加,TFPS 中中性糖的含量增加,而酸性糖的含量先增加后减少 [ 19]。Li等人使用600 W微波仪器提取粗绿茶粗TPS(CTPS),提取过程重复3次。经MAE提取后,CTPS中可溶性蛋白的含量是所有测试方法中最高的,达到5.93%。此外,他们发现 MAE 处理对高 Mw 的 CTPS 链几乎没有影响,但会导致小 Mw CTPS 的急剧降解。根据相关报道,小分子量多糖往往比其高分子量多糖具有更好的生物活性[ 42 ]。随后朱等人用 MAE 法制备的 CTPS 的体外活性试验,也证实了这一结论 [ 21]。与其他提取方法相比,MAE法具有提取效率高、纯度高、活性成分不可降解、操作方便、省时、环保等优点。这是一种“绿色提取工艺”,使其广受欢迎。MAE虽然在TPS提取方面具有良好的前景,但也存在提取成分复杂、后期分离纯化困难、需要极性溶剂等缺点[ 43 ]。因此,除了基本的封闭和开放系统外,还开发了真空微波辅助萃取、氮气保护微波辅助萃取、超声微波辅助萃取和动态微波辅助萃取等几种改进的微波萃取技术。 [41 ]。
5. 酶解提取
酶解法是指用酶水解破坏植物细胞壁。细胞壁分解成易溶于萃取溶剂的小分子物质,从而加速活性成分的溶解。酶解提取的TPS的得率通常较高,混合酶的效果优于单一酶。但酶的活性易受反应温度、pH、浓度等因素的影响,因此对实验条件和成本的要求通常较高。Baik 等人研究了果胶酶和鞣酸酶同时处理对绿茶中 TPS 提取的影响。28 ]。Chang等人利用果胶酶辅助提取获得绿茶TPS,初步提取工艺如下:将磨碎的茶粉在90°C的水浴中加热2-4小时,0.5%果胶酶(260,001加入PGU/mL, v / w ) 并在 40°C 下孵育 30 分钟,然后通过在 90°C 下加热 1 小时使酶失活。制备的 TPS 具有出色的免疫刺激和对免疫细胞的保护作用 [ 30]。除了生物活性外,产率也是酶解提取的一个问题。Zhu 等人使用混合酶(纤维素酶:果胶酶:葡聚糖酶 = 1:1:2)在 50 °C(30 分钟)下提取粗绿茶多糖(CTPS),然后煮沸使酶失活(10 分钟)并在 50°C 水浴中萃取 80 分钟。整个过程重复了三遍。用该方法获得的 CTPS 总糖含量较高(71.83%),这主要归因于混合酶对细胞壁的温和有效破坏 [ 21 , 44]。Wang 等人使用 0.5% (m/v) 戊聚糖复合酶溶液(45 °C,pH 5.5)从用 95% 乙醇预处理 2 小时的绿茶叶和花中提取 TPS。过滤后,在相同温度下重复相同的提取过程。用这种方法获得的两种 TPS 的收率分别为 4.08% 和 6.88%,远高于相同条件下热水提取的收率(分别为 1.28% 和 2.93%)[ 38]。与传统的溶剂提取法相比,酶解提取法具有提取效率高、特异性强、提取率高等优点。此外,还可以减少因使用大量溶剂而造成的环境污染,具有广阔的应用前景。但由于酶的价格相对较高,其活性受多种因素影响,因此必须严格控制酶解提取的提取条件,才能有效获得较高的提取率。
6. 其他提取方法
除了上述常见的提取方法外,还报道了一些新的TPS提取方法。例如,Xu 等人使用水/溶剂热法优化了萃取条件。他们利用高温高压(120℃,0.1MPa)使水分渗入中茶108茶叶中,破坏泡孔结构,从而分离出TPS[ 1 ]。该方法得到的粗多糖的提取率为4.7%,远高于紫阳绿茶(3.46%)[ 22 ]、黄山毛峰茶(2.3%)等普通热水提取得到的TPS。 23 ]、祁门红茶 (3.2%) [ 24]。孙等人用碱辅助提取法提取茯砖茶多糖(FBTPS);萃取条件为 60 °C 萃取温度和 0.1 mol/L NaOH 溶液(pH = 10.0)。与热水提取相比,碱提取 FBTPS 的产量对单糖组成和产量的影响更大[ 30 ]。此外,近年来新兴的提取技术超临界流体萃取(SFE)也被用于提取多糖。许多研究人员已经使用 SFE 提取各种植物来源的多糖,尽管这种工艺在 TPS 提取中的应用仍然很少。Chen 等人用 CO 2提取 TPS基于 SFE 方法,他们确定了该方法在 TPS 提取中的最佳参数为粒径 380 μm、20% 无水乙醇、提取压力 35 MPa、提取温度 45 ℃、提取时间 2 h,TPS 提取率高达 92.5%。此外,用这种方法获得的 TPS 具有显着的生物活性 [ 31 ]。尽管 SFE 方法令人印象深刻、易于管理、高效且环保,但由于其昂贵且耗时的设备,在实际应用中仍不如其他提取方法普遍。此外,Li 等人发现通过阴离子反胶束系统萃取具有传质快、选择性高、成本低等优点 [ 32]。总之,TPS提取的各种辅助方法能够提高多糖的生物活性,缩短提取时间,提高提取得率。
This entry is adapted from the peer-reviewed paper 10.3390/polym14142775
This entry is offline, you can click here to edit this entry!
