神经性疼痛是由体感神经系统受累的组织损伤或疾病引起的慢性疼痛,严重影响患者的身体机能和生活质量。皂苷是一类结构多样的化合物,由皂苷元和糖基组成。构成皂苷的糖类常见的有D-葡萄糖、D-半乳糖、D-木糖、L-阿拉伯糖、L-鼠李糖等。
1.人参皂甙
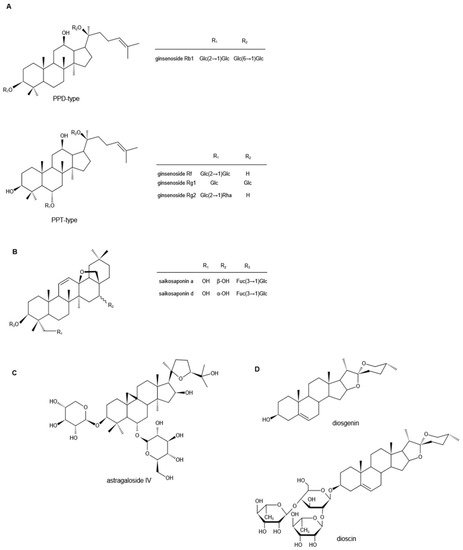
人参皂甙是人参的主要生物活性成分 ,具有广泛的药理活性。根据其苷元的骨架,人参皂苷可分为两类,四环三萜达玛烷型皂苷(原人参二醇(PPD)型,原人参三醇(PPT)型)(
图1A)和四环三萜齐墩果烷型皂苷[
48 ,
49 ,
50 ]。迄今为止,已分离出100多种不同的人参皂苷单体,如人参皂苷Rb1、Rb2、Rc、Rd、Re、Rg1和Rf,它们的药理和药代动力学特性各不相同
[ 51、52
]。
图 1. 人参皂苷(A)、柴胡皂苷(B)、黄芪甲苷(C)、薯蓣皂苷元和薯蓣皂苷(D)的化学结构(注:PPD,原人参二醇;PPT,原人参三醇;Glc,葡萄糖苷;Rha,鼠李糖苷;Fuc,果糖苷)。
基于动物模型的数据表明,人参皂苷在神经性疼痛中发挥有益作用。在 Jee Youn Lee 等人进行的一项研究中。[
21],外周和中枢神经性疼痛分别由雄性 SD 大鼠的尾神经损伤或挫伤性脊髓损伤 (SCI) 引起。口服总皂苷(TSE)人参皂甙Rb1后显示出显着的镇痛作用。研究发现,TSE和人参皂甙Rb1抑制小胶质细胞/星形胶质细胞的活化,降低炎症因子水平,如白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、诱导型一氧化氮合酶(iNOS)、和环氧合酶-2 (COX-2)。进一步的结果表明,TSE、人参皂甙 Rb1 和 Rb1-代谢物-化合物 K 也发挥可能通过雌激素受体介导的镇痛作用。高超等人进行的其他研究。据报道,鞘内注射人参皂苷 Rg1 以剂量依赖性方式显着抑制慢性缩窄性损伤(CCI)诱导的热痛觉过敏。它可能通过抑制磷酸化 p38 丝裂原活化蛋白激酶 (p-p38MAPK) 和核因子 kappa-B (NF-κB) 亚基磷酸化 p65 的表达,以及离子化钙结合接头分子-1 (IBA-1) 的激活来介导在脊髓小胶质细胞中,导致中枢敏化的下调[
22 ]。此外,其他研究表明,在 CCI 大鼠的脊髓和 DRG 中,人参皂甙 Rf 显着降低了 IL-1β 和 IL-6,但增加了背根神经节 (DRG) 中 IL-10 的表达 [
23 ]。因此,人参皂甙 Rf 可以调节促炎因子和抗炎因子之间的平衡,从而促进其在神经性疼痛中的镇痛作用。
许多研究揭示了促炎细胞因子在神经性疼痛的病理生理学中的关键作用 [
53 ,
54 ,
55 ,
56 ]。上述研究均说明相关人参皂苷通过不同途径抑制炎症以缓解神经性疼痛。此外,其他研究表明,人参皂甙Rb1抑制神经元凋亡[
24 ],促进神经发生,调节脑源性神经营养因子(BDNF)和caspase-3的表达,发挥神经保护作用[
57 ]。另一方面,临床上慢性疼痛患者常伴有抑郁症,部分抑郁症患者还伴有慢性躯体疼痛症状[
58 ]]。因此,疼痛与抑郁症发生的关系成为近期研究的重点。研究表明,腹腔注射人参皂甙 Rg2 不仅可以缓解 CCI 大鼠的机械性异常性疼痛和热痛觉过敏,还可以缓解焦虑和抑郁 [
59 ]],尽管其潜在机制需要进一步探索。迄今为止,人参皂苷在神经性疼痛中的镇痛机制大多局限于对炎症因子的探索,缺乏对其靶向分子靶点的深入分析。此外,人参皂甙的调节作用是否与不同的神经性疼痛相关脑区有关,在很大程度上仍是未知数。围绕这些点开展进一步的研究可为药品的精准调控提供研究依据。
2.柴胡皂苷
柴胡皂甙是从 传统中药材之一 的
伞形科中的柴胡 (
Bupleurum scorzonerifolium)中 提取的,是
柴胡的主要活性成分 [
60 ]。
迄今为止,已从柴胡中分离出100多种柴胡 皂甙,
其中主要有齐墩果烷和熊果五环三
萜皂甙[
61,62,63,64,65]。柴胡皂苷按其化学结构分为-A、-B、-C、-D、-M、-N、-P、-T类,其中柴胡皂苷D(SSD)被认为是活性最高的一类,其次是柴胡皂苷 A (SSA) [
66 ,
67 ]。它们的化学结构
如图 1 B所示。
体内外实验研究均表明,柴胡皂苷能抑制瞬时受体电位锚蛋白1(TRPA1)的激活,显着降低异硫氰酸烯丙酯(AITC)诱导的动物伤害性反应[
25 ]。分子对接和定点诱变分析表明,柴胡皂苷与 Asn855 残基附近的 TRPA1 疏水袋结合,后者一旦突变为 Ser,并且以前与增强的人类疼痛感知结合在一起 [
25 ,
68 ]。Gyeongbeen 还报道,SSD 的多次给药可以显着缓解长春新碱诱导的机械超敏反应,这部分是通过抑制 TRPA1 的活性来实现的 [
25]。因此,可以进一步推测SSD可能在化疗药物、糖尿病或CCI诱发的神经性疼痛中发挥一定的治疗作用,其中TRPA1的表达和敏感性也发生了改变,导致疼痛反应和知觉异常。 [
69、70、71、72、73 ]。_
_ _
_ _
_ _ 然而,SSD 的镇痛作用在链脲佐菌素 (STZ) 和紫杉醇诱导的疼痛模型之间是不同的。前者短期口服有效,后者需要多次给药才能缓解疼痛[
26]。这表明 SSD 的镇痛作用不仅可以作为 TRPA1 的拮抗剂,还可以发挥抗炎活性,减少神经损伤引起的氧化应激。相关研究报道,SSD可以抑制糖皮质激素受体向线粒体的易位,减少H
2 O
2诱导的细胞外调节激酶(ERK)、c-Jun N-末端激酶(c-JNK)和p38MAPK 下调神经元 PC12 细胞的活性 [
27 ,
74 ,
75 ]。
众所周知,DRG 和脊髓神经元中 NF-κB 的激活与伤害感受信息的转导和处理有关。因此,抑制 NF-κB 可以缓解慢性疼痛状态 [
76 ]。研究表明,SSA 通过抑制 CCI 诱导的脊髓 p-p38 MAPK 和 NF-κB 水平升高来减轻神经性疼痛 [
28 ]。此外,细胞因子失调是神经性疼痛症状的特征性表现之一 [
77]。还可以发现,SSA 显着抑制某些免疫相关细胞毒因子的表达,包括 COX-2 和 iNOS,以及类似的促炎细胞因子,如 TNF-α、IL-1β 和 IL-6 . 同时,重要的抗炎细胞因子 IL-10 的表达显着上调,表明它在脂多糖 (LPS) 刺激的巨噬细胞中具有抗炎活性 [
29 ,
30]。进一步的研究表明,SSA 通过阻止 NF-κB 抑制剂 α (IκBα) 的磷酸化来阻断 NF-κB 信号通路,从而使 p65 NF-κB 保留在细胞质中,防止其转移到细胞核。此外,SSA 通过下调 p38 MAPK、c-JNK 和 ERK 的磷酸化来抑制 MAPK 信号通路,从而发挥抗炎活性 [
30 ]。在此基础上,SSA 似乎通过抑制水通道蛋白 4 (AQP-4) 和基质金属蛋白 9 (MMP-9) 来抵消创伤性脑损伤后的神经功能缺陷,以解释其神经保护作用 [
31]。另一方面,Seong Shoon Yoon 等人的研究。表示 SSA 主要通过介导 GABAB 受体对吗啡强化行为和药物成瘾表现出显着的抑制作用 [
78 ,
79 ]。Davoud Ahmadimoghaddam 等人。据报道, 以 SSA 为主要成分之一的
柴胡 精油,通过调节 L-精氨酸
-NO -cGMP-KATP 通道通路,以及与阿片类药物、过氧化物酶体增殖物激活的和大麻素受体 [
32]。电压门控钠通道 Nav1.7 是一种对河豚毒素敏感的钠通道亚型,由 SCN9A 编码。众所周知,Nav1.7 的功能障碍与疼痛障碍有关 [
80 ]。相关研究表明,SSA通过对Nav1.7峰值电流的强抑制作用,对小鼠热痛和福尔马林引起的疼痛具有镇痛作用[
33 ]。
上述研究表明,SSD和SSA可通过多种途径在不同的神经性疼痛模型中发挥镇痛作用,其作用机制有异同。后续可以结合它们的结构特点和作用机制进行深入分析,为靶点的精准调控提供研究依据。
3. 黄芪甲苷
黄芪,黄芪 (Fisch.)Bge 的干燥根 。
变种。mongholicus (Bge.) Hsiao,或
黄芪 (Fisch.) Bge.,被称为高档中药 [
81 ]。黄芪中的化合物主要有三类:皂甙、黄酮和多糖,其中三萜皂甙是
主要成分[
82、83、84]。据报道,通过HPLC和GC-MS从干燥的黄芪根中分离鉴定了40多种皂苷,如黄芪甲苷I-VIII、乙酰黄芪甲苷、异黄芪甲苷I、III、黄芪甲素II、环黄芪甲苷、环黄芪苷B、短叶黄芪苷等。 B, astrasieversianin X, 等 [
85 ,
86 ,
87 ,
88 ]。其中,黄芪甲苷(AS-IV)被称为主要活性成分和定性控制生物标志物。AS-IV是3
-O-β-d-xylopyranosyl-6-O-β-d-吡喃葡萄糖基-
环黄芪醇(
图1C ),分子式为C
41 H
68O
14 [
89 ]。
人们普遍认为,瞬时受体电位香草素 1 (TRPV1) 通道是一种对热毒和辣椒素等各种刺激的多模式受体,也是一种重要的疼痛传感器 [
90 ,
91 ]。在炎症或神经损伤的情况下,TRPV1 在 Aδ 纤维和 C 纤维中过度表达 [
92 ]。此外,嘌呤能 P2×3 受体是配体门控的非选择性阳离子通道,在与伤害感受信息相关的小直径和中等直径感觉神经元中高度选择性表达,在病理性疼痛的产生和维持中起关键作用[
93,
94]。在 Guo-Bing Shi 等人的研究中,AS-IV 不仅显着下调 Aδ 纤维中 TRPV1 的表达,显着上调伤害性阈值,而且抑制 DRG 神经元中 P2×3 的表达,从而减轻机械性异常性疼痛 [
34 ]。同时,AS-IV 通过在雪旺细胞和神经细胞之间的髓鞘碎片中积累胶质细胞源性神经营养因子家族受体α1(GFRα1),即胶质细胞源性神经营养因子(GDNF)选择性受体,恢复了受损坐骨神经的组织学结构。受损的轴突 [
34 ]。它还降低了 DRG 中 GFRα1 和 GDNF 的水平,这些水平由 CCI 高度表达和诱导,有助于恢复受损的神经纤维 [
95 ,
96]。
在周围神经系统中,适当剂量的AS-IV也能大大促进周围神经的再生[
35 ]。生长相关蛋白 43 在脊髓 L4-6 段中较低,但在正常 Balb/c 小鼠的生长神经元轴突中活跃。作为神经损伤中的一种特殊生物标志物,它在神经生长中起着至关重要的作用,并与神经元轴突生长密切相关 [
36 ,
89 ,
97 ,
98]。既往研究表明,AS-IV 显着上调再生神经组织中生长相关蛋白 43 的表达,从而增加小鼠坐骨神经中有髓神经纤维的数量和直径,同时提高运动神经传导速度和动作电位幅度。
36 ]。此外,AS-IV 还对 STZ 诱导的糖尿病大鼠的周围神经病变产生镇痛作用。首先,它降低了糖尿病大鼠的血糖和糖化血红蛋白 (HbA
1 C) 水平,并增加了血浆胰岛素水平 [ 37 ]。
控制 HbA 1水平至关重要C,因为它的浓度与糖尿病相关并发症的发生率密切相关,这已被临床试验证明 [
99 ]。其次,AS-IV 增强了神经中谷胱甘肽过氧化物酶的活性,抑制了红细胞中醛糖还原酶的活化,减少了神经和红细胞中晚期糖基化终产物的积累,这不仅可能激活细胞抗氧化防御系统,而且还增强了抗氧化应激损伤对周围神经的能力。第三,AS-IV作为AR抑制剂,然后增强Na
+,K
+-ATP酶活性,改善延迟的运动神经传导速度,增加神经血流量,并防止结构性神经纤维损伤以纠正周围神经缺损[
37 ]。
4.薯蓣皂苷元
薯蓣皂苷元是一种天然存在的甾体皂苷元,在自然界中含量丰富。
薯蓣皂苷元的主要来源包括三 种薯蓣 属物种和一种 异
菝葜 物种,即
D. zingiberensis、
D. septemloba、
D. collettii和
H. yunnanensis [
100 ]。薯蓣皂苷元也可以从胡芦巴 (
T. foenum graecum Linn ) 和
Costus speciosus [
101 ,
102 ,
103 ] 中获得。它是一种C27螺缩酮类固醇皂苷元,3β-羟基-5-螺甾烯(
图1D),其分子式为C
27 H
42 O
3 [
104 ]。作为具有代表性的植物甾体,薯蓣皂苷元是生产甾体激素类药物的重要基础原料,几十年来越来越受到制药行业的关注[
105 ]。此外,薯蓣皂苷元本身具有广泛的生物学作用。以下研究主要描述了其在神经性疼痛中的作用。
神经性疼痛是糖尿病的常见并发症之一,表现为对有害刺激的敏感性增加 [
106 ]。为了评估薯蓣皂苷元在治疗糖尿病引起的神经性疼痛中的作用,对 STZ 引起的糖尿病大鼠模型进行了体内研究。研究表明,薯蓣皂苷元可提高糖尿病大鼠福尔马林试验后期的机械和热伤害感受阈值并降低疼痛评分 [
38 ]。由于氧化应激升高是糖尿病相关神经功能障碍的关键因素之一,可导致血管功能障碍,导致神经内缺氧,进而导致运动和感觉神经功能受损[
107 ,
108 ]]。研究表明,薯蓣皂苷元可降低糖尿病大鼠血清、DRG和坐骨神经中丙二醛(MDA)的含量,恢复超氧化物歧化酶(SOD)和过氧化氢酶的活性,从而抑制氧化应激,增强抗氧化防御系统的功能。 [
38 ]。此外,NF-κB 是一种重要的核转录因子,负责控制编码炎症和伤害感受相关介质的基因 [
109 ]。已证实糖尿病大鼠背根神经节神经元中 NF-κB 的上调,其抑制显着降低伤害性反应 [
110 ,
111 ,
112]。据报道,薯蓣皂苷元在 LPS 诱导的肺损伤模型中下调 NF-κB p65/p50 信号通路 [
113 ]。但从现有报道来看,薯蓣皂苷元是否通过调节NF-κB发挥其在糖尿病性神经性疼痛中的镇痛作用尚无具体的实验研究,相关研究有待进一步开展。神经生长因子(NGF)作为一种神经营养因子,是一种蛋白质因子,在维持交感神经和感觉神经元的生长、发育和功能方面起着至关重要的作用。它刺激轴突生长,保持轴突大小,防止成熟神经元受伤后死亡,并调节神经系统的各种功能,包括突触可塑性和神经传递 [
114 ,
115 ]。在糖尿病神经病变中,NGF功能受损,NGF相关基因表达发生改变,是糖尿病神经病理性疼痛进展的重要因素。Tong Ho KANG 等人进行的一项研究。揭示薯蓣皂苷元上调糖尿病大鼠坐骨神经中NGF的水平。类似的效果还报道了薯蓣皂苷元增加 PC12 细胞的神经突生长,通过诱导 NGF 提高糖尿病小鼠的坐骨神经传导速度,减少髓鞘干扰,增加有髓轴突的面积,改善受损轴突的信号传递,从而减轻糖尿病性神经性疼痛 [
39 ]。
除了糖尿病神经病变模型外,薯蓣皂苷元在治疗神经性疼痛中的作用也已在 CCI 大鼠模型中得到报道。2017年,赵伟新等。进行了一项体内研究,结果表明薯蓣皂苷元可以上调 CCI 降低的机械戒断阈值和热戒断潜伏期。这是因为薯蓣皂苷元不仅抑制了 CCI 诱导的促炎细胞因子 TNF-α、IL-1β 和 IL-2 的升高,而且还抑制了脊髓中的氧化应激。此外,薯蓣皂苷元通过抑制 p38 MAPK 和 NF-κB 信号通路的激活,显着抑制 p-p38 MAPK 和 NF-κB 的表达,减轻 CCI 大鼠的神经性疼痛[
40 ]。在其他研究中 [
41],大鼠坐骨神经损伤降低了坐骨神经功能指数,该指数被广泛用于评估功能性步态 [
116 ],增加腹外侧导水管周围灰质和室旁核中 c-Fos 的表达,抑制了由以下因素引起的运动功能的恢复。 BDNF 的过度表达,以及对炎症有反应的 COX-2 和 iNOS 的过度表达。幸运的是,薯蓣皂苷元能够显着改善上述病理状态,并在周围神经损伤后发挥控制疼痛和功能恢复的潜在能力。
3.5. O. sanctum 富含皂苷的提取物
除了上述四种已鉴定出结构清晰的植物皂苷的镇痛作用外,还发现了富含皂苷的O. sanctum提取物具有相似的作用。O. sanctum是唇形科植物罗勒的地上部分。现代药理研究表明,O. sanctum化学成分复杂,种类多样,包括挥发油、黄酮类及其苷类、香豆素类、苯丙素类和脂肪酸类,主要是挥发油和黄酮类及其苷类[111]。此外,已从O. sanctum的酒精提取物中分离出多种皂苷。[112],其中最重要的是以熊果酸和齐墩果酸为主的五环三萜皂苷[113-115],具有广泛的药理作用。
氧化应激 [116] 和钙稳态的改变 [117] 被认为与神经性疼痛密切相关。在神经系统疾病期间,细胞内钙调节系统的功能障碍会产生氧化应激 [118],而自由基的增加会导致神经元变性和细胞凋亡。另一方面,由氧化应激引起的代谢异常[119]、蛋白质聚集体的形成[120]和膜通透性的变化[121]都会增加钙水平,它们共同作用促进神经性疼痛的恶化。O. sanctum具有良好的抗氧化作用 [122,123],可防止自由基损伤 [124],并且能够降低钙水平 [125]。O. sanctum在印度部分地区用作神经补品,用于缓解头痛、关节痛和肌肉痛。在 Muthuraman 等人进行的实验中,O. sanctum的给药减轻了坐骨神经横断引起的周围神经病变和运动协调,减弱了截肢引起的硫代巴比妥酸活性物质、总钙和谷胱甘肽水平的降低以剂量依赖的方式[125]。提示O. sanctum的镇痛作用可能与其抗氧化和降低钙水平有关。此外,在其他研究中,用O. sanctum治疗其富含皂苷的部分可减轻由慢性缩窄性损伤和化学治疗剂长春新碱引起的神经性疼痛,这与其对氧化应激和钙水平的影响有关[125,126]。基于上述发现,可以观察到,O. sanctum给药对钙水平的下调可能是由于直接影响或继发于氧化应激的降低。然后,它对神经元产生镇痛或抗凋亡作用。据报道,皂苷具有抗氧化作用 [127] 和降钙作用 [128]。因此,O. sanctum皂苷的镇痛作用可以通过直接或间接降低钙水平来构建。
还有证据表明,O. sanctum叶子和种子可降低兔子的尿酸水平 [129],而尿酸水平升高与痛风性关节炎和其他关节炎症有关 [130]。O. sanctum的乙醇提取物具有镇痛作用,并涉及神经递质系统(如阿片受体和去甲肾上腺素)的相互作用 [131]。这些研究支持传统使用O. sanctum治疗炎症和疼痛,但不排除其他活性成分如黄酮类和酚类的作用。
This entry is adapted from the peer-reviewed paper 10.3390/molecules27123956