Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Nutrition & Dietetics
尿石素 A (Uro A) 是哺乳动物摄入植物性食物成分鞣花单宁和鞣花酸后肠道微生物群的饮食代谢物。越来越多的研究报告了它对多种疾病的多种潜在健康益处,包括心血管疾病、癌症、认知障碍和糖尿病。特别是,Uro A 通过直接口服给药是安全的,并且没有遗传毒性。胰腺通过分泌消化酶和激素在调节能量消耗和新陈代谢方面发挥核心作用。许多病理生理因素,如炎症、线粒体自噬缺陷和内质网应激,会对胰腺产生负面影响,导致胰腺疾病,包括胰腺炎、胰腺癌和糖尿病。
- urolithin A
- pancreas
- autophagy
- microbiota
- diet
1. 减少胰腺炎症因子的表达
胰腺炎性微环境导致胰腺炎,是内分泌功能下降的主要原因[ 83 ]。一些研究人员认为,如果 β 细胞表达高水平的 NF-κB 信号标记,细胞的增殖和再生潜力就会降低。表达 NF-κB 的 β 细胞也出现了socs2的过早上调,这是一种抑制增殖的基因 [ 84 ]。已广泛报道 EA 可抑制胰腺炎症(表 1)。在自发性慢性胰腺炎的实验模型中,雄性 Wistar Bonn/Kobori 大鼠被喂食添加 EA(100 mg/kg 体重/天)的饮食十周。他们发现 EA 通过增加胰腺重量和降低 MPO 活性(中性粒细胞浸润指数)、胶原蛋白含量、转化生长因子-β1 (TGF-β1) 表达、活化胰腺星状细胞 (PSC) 和 ED- 来减轻胰腺炎症和纤维化。 1 阳性细胞 [ 85 ]。正宗等人。还报道 EA 抑制 PSC 中单核细胞趋化蛋白 1 (MCP-1) 的产生和激活蛋白 1 (AP-1) 和 MAPK 的激活,所有这些均由白细胞介素 (IL)-1β 和 TNF-α 诱导 [ 86]。同时,EA 抑制 PDGF-BB 诱导的 PDGF P 受体酪氨酸磷酸化以及 PSC 中下游 ERK 和 Akt 的活化。特别是,EA 抑制 PSC 中响应 TGF-β1 或血小板衍生生长因子 (PDGF) 的 ROS 产生 [ 87 ]。
表 1.尿石素 A 及其前体化合物 EA 对胰腺疾病的潜在影响和机制。
| 疾病模型 | 治疗 | 代谢反应 | 参考。 |
|---|---|---|---|
| 雄性 Wistar Bonn/Kobori 大鼠的自发性 CP | 100 mg/kg BW/天与 EA 一起口服给药 10 周 |
|
[ 85 ] |
| 从大鼠胰腺组织中分离出 PSC,以培养活化的肌成纤维细胞样表型 | 1–25 μg/mL EA |
|
[ 86 ] |
| L-精氨酸诱导大鼠 AP | 85 mg/kg 与 EA 一起口服 |
|
[ 87 ] |
| 使用 25 mM 葡萄糖和 0.5 mM 棕榈酸诱导 MIN6 β 细胞炎症 | 尿素A |
|
[ 88 ] |
| C56BL6/J 小鼠中的酒精相关 CP | 在酒精相关 CP 诱导的最后 3 周内给药 |
|
[ 89 ] |
| 通过 HFD 和腹膜内 STZ 注射实现雄性 C57BL/6 小鼠的 DM | 50 mg/kg BW/天与 Uro A 一起口服给药 8 周 |
|
[ 90 ] |
| 人 PDAC 细胞系;PDAC 小鼠是通过将 PANC1 细胞注射到 6 周大的 Fox1-nu/nu 小鼠的侧腹来实现的 | 0–100 微米; 20 mg/kg BW/天(5 天/周)与 Uro A 一起口服 |
|
[ 91 ] |
| PKT(Ptf1a cre/+;LSL-Kras G12D;Tgfbr2 fl/fl)小鼠,一种具有攻击性的基因工程 PDAC 小鼠模型 | 口服 Uro A 5 周 |
|
[ 92 ] |
| 新生 STZ 诱导的非肥胖 T2DM 大鼠 | 25–100 mg/kg BW 与 EA 一起口服给药 |
|
[ 93 ] |
尽管 EA 有许多有希望的发展,但它在人体肠道中的吸收很差,限制了它的抗炎作用。如上所述,EA 被微生物代谢成一系列下游化合物,如 Uro A [ 5 ]。暴露于 Uro A 的临床前模型的一个众所周知的效果是有害炎症反应的减弱 [ 94 ]。Uro A 显示出比 EA 或 ET 更有效的抗炎特性,表明它可能是治疗 AP 或 CP 的主要化合物(表 1)。首次报道抗炎作用可降低急性结肠炎大鼠炎症标志物 COX-2 的 mRNA 和蛋白质水平 [ 95]。张等人。首次报道 Uro A 通过调节 AMPK 抑制 MIN6 β 细胞中含有 3 (NLRP3)/IL-1β 炎症信号的硫氧还蛋白相互作用蛋白 (TXNIP)/Nod 样受体家族 pyrin 结构域(图 2)[ 88 ]。最后,他们证明 Uro A 还下调蛋白激酶 RNA (PKR) 样 ER 激酶 (PERK) 并促进 AMPK 磷酸化 [ 96 ]。最新研究表明,Uro A 可以通过调节 PI3K/AKT/mTOR 信号轴来减轻 C56BL6/J 小鼠酒精相关慢性胰腺炎 (ACP) 的严重程度 [ 89 ]。
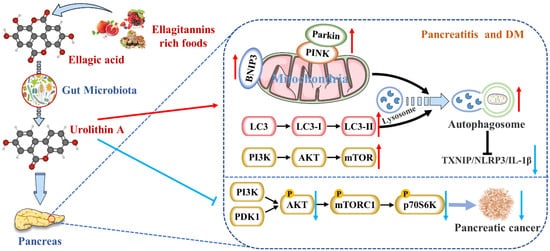
图 2. Uro A 在哺乳动物摄入 ET 和 EA 后被肠道微生物群代谢,具有多种潜在的健康益处。Uro A 可通过抑制炎症信号通路、激活自噬、维持线粒体功能和改善免疫微环境来减轻胰腺疾病。
然而,Uro A 减少胰腺炎症的研究仅在动物和细胞中得到验证,而没有进行临床研究。Uro A 抗炎作用的上游介质,包括 NF-κB 和 AhR-Nrf2 通路,主要在体外进行了研究 [ 36 ]。然而,Uro A 在炎症背景下的作用机制似乎因组织和条件而异。因此,Uro A 对 AP 和 CP 的缓解程度和机制的差异需要进一步探讨。
2. 激活自噬并维持胰腺中的线粒体功能
线粒体损伤,例如线粒体 DNA (mt DNA) 完整性的丧失、线粒体形态的改变和功能障碍,可导致细胞衰老和凋亡 [ 97 ]。一方面,线粒体在 β 细胞中既充当营养传感器,又充当胰岛素分泌的信号发生器。此外,营养物质可以抑制 ATP 敏感的 K + (K ATP ) 通道,然后通过作为线粒体 ATP 合成的底物(触发途径)或通过调节 Ca 2+来增强胰岛素分泌。通道(放大途径)。另一方面,线粒体是电子传递链水平上活性氧 (ROS) 的主要来源,因此线粒体可能是 ROS 损伤的主要目标 [ 98 ]。此外,许多研究揭示了胰腺疾病与线粒体动力学失调(包括融合和裂变)之间的因果关系 [ 97 , 99 , 100 ]。因此,线粒体损伤导致胰腺功能下降。Uro A 在不同物种(包括细胞、蠕虫、小鼠和人类)中最一致的效果是改善线粒体健康 [ 94]。这种益处是由功能失调的线粒体(称为选择性自噬)的清除和回收驱动的 [ 101 ]。例如,Uro A 增加了编码 LC-3B 的线粒体自噬基因lgg-1、pink-1和pdr-1的表达,并增加了秀丽隐杆线虫中自噬体囊泡的形成 [ 29 ]。
有趣的是,小胶质细胞中的 Pink1 敲低消除了 Uro A 介导的 TNF-α 减少并增加了 IL-10,这表明 Uro A 通过诱导线粒体自噬来减少神经炎症 [ 34 ]。张等人。还证明 Uro A 通过调节自噬抑制 MIN6 β 细胞中糖脂毒性诱导的 ER 应激和 TXNIP/NLRP3/IL-1β 炎症信号 [ 88 ]。值得注意的是,Uro A 对 p62 的抑制作用强于 TXNIP 抑制剂维拉帕米 ( p < 0.05) [ 102 ]。在糖尿病小鼠的胰腺细胞中也报道了 Uro A 促进 PINK1/Parkin 介导的线粒体自噬 [ 90]。因此,Uro A恢复正确的线粒体自噬水平以维持正常的线粒体功能极有可能是Uro A减少胰腺疾病的机制(图2)。
3. 抑制胰腺内质网应激
内质网 (ER) 中蛋白质折叠的错误折叠和抑制导致未折叠蛋白质的聚集,从而导致 ER 应激 [ 103 ]。李等人。表明伴随蛋白质聚集体积累的ER应激和未折叠蛋白反应(UPR)成为受衰老影响的重要途径,特别是在β细胞中。同时,UPR 成分的转录组失调与激活转录因子 6 (ATF6) 和肌醇需要酶 1 (IRE1) 信号通路有关 [ 8 ]。ER 应激相关的细胞凋亡导致 β 细胞增殖和再生减少,最终导致胰岛素分泌减少和 T2DM 发病率增加 [ 104]。因此,在衰老过程中保持转录稳定性和减少蛋白质稳态损失对于恢复胰腺功能至关重要。据报道,Uro A 可抑制胰腺 β 细胞中糖脂毒性诱导的 ER 应激 [ 88 ]。然而,需要对 Uro A 在胰腺中的上游和下游通路进行更多的研究,以改善 ER 应激。
4. 抑制胰腺肿瘤的发生和发展
大量摄入富含 ET 的浆果,包括草莓、石榴和蓝莓,与 PDAC 发病率呈负相关 [ 105 ]。EA 是鞣花单宁的一种肠道代谢产物,可抑制 PDAC 中激活的多种致癌途径,例如 COX-2、NF-κB 和 Wnt 信号传导,因此 EA 成功地阻止了细胞周期并逆转了 PDAC 中的上皮向间质转化 [ 106 ]。作为 EA 的下游化合物,Uro A 显示出更有效的抗氧化和抗炎特性,提高生物利用度和抗肿瘤作用 [ 107 ]。已经证明 AKT 的 S473 磷酸化位点被 PI3K 激活 [ 108]。Uro A 治疗导致 PDAC 细胞系中磷酸化 AKT (p-AKT) 表达呈剂量依赖性降低,从而导致 mTORC1 复合物调节的磷酸化 p70 S6 激酶 (p-PS6K) 表达显着下调。因此,Uro A 通过下调 PI3K/AKT/mTOR 通路抑制 PDAC 细胞的增殖和迁移,增强细胞凋亡 [ 109 ](图 2)。此外,Uro A 治疗还下调 PDK1(AKT 的上游靶点)和 p-GSK3β 和 p-4E-BP1(AKT 的下游靶点),表明 Uro A 有效抑制 PDK1/AKT/mTOR [ 110]。Uro A 治疗还减少了 PDAC 工程化 PKT 小鼠模型中的免疫抑制性肿瘤相关巨噬细胞 (TAM) 和调节性 T 细胞。这意味着 Uro A 治疗通过诱导 PDAC 免疫抑制微环境的变化来减弱肿瘤生长并延长小鼠的存活时间 [ 91 ]。斯里尼瓦桑等人。还指出 Uro A 抑制 AKT、PS6K 和 STAT3 信号传导,从而减少 Ki67 阳性肿瘤细胞并增加 PDAC 小鼠胰腺组织中 cleaved caspase-3 的表达 [ 92 ]。这些结果表明,Uro A 是一种新型的 PDAC 多信号通路抑制剂/调节剂,具有预防和治疗胰腺癌的潜力(表 1)。
5. 保护胰腺β细胞
关于 Uro A 对 DM 及其并发症的改善作用已有许多研究。具体来说,Savi 等人。首次表明 Uro A 在糖尿病心肌病 (DCM) 大鼠中恢复了心肌细胞的收缩力和钙动力学 [ 111 ]。阿尔巴舍等人。进一步证明 Uro A 通过激活 SIRT1 表达和脱乙酰酶活性来预防大鼠中链脲佐菌素 (STZ) 诱导的 DCM [ 112 ]。肖等人。表明 Uro A 可以通过 N-聚糖生物合成途径改善全身炎症和肠道屏障功能障碍,从而减轻 DM 相关的认知障碍 [ 113]。这一结论也得到了 Lee 等人的支持。他们指出,Uro A 通过减少 2 型转谷氨酰胺酶 (TGM2) 依赖性线粒体相关 ER 膜 (MAM) 的形成和维持线粒体钙和 ROS 稳态来预防 DM 相关的 AD [ 35 ]。徐等人。表明 Uro A 通过激活 Nrf2/HO-1 通路抑制炎症和氧化应激来改善糖尿病视网膜病变 [ 114 ]。周等人。发现余甘子通过调节由 ET 代谢物介导的 Akt/β-连环蛋白信号传导促进 STZ 诱导的高血糖大鼠的血管功能 [ 115 ]。
胰岛素抵抗是DM的核心机制之一。然而,作为一种复杂的全身性代谢疾病,仅靠胰岛素抵抗是不足以引起糖尿病的。胰岛β细胞总量减少引起的胰岛功能障碍也是DM发病的关键。研究表明,T2DM 中的 β 细胞可分为三种主要状态:易感性、适应和失效[ 116、117、118 ]。在胰岛素抵抗期间,β 细胞通过分泌胰岛素增加胰岛素需求来补偿功能障碍 [ 90 ]。当 β 细胞不能补偿葡萄糖稳态时,就会发生高血糖症。更重要的是,来自余甘子的 EAL. 增加糖尿病大鼠 β 细胞的大小或数量。EA 还直接增加分离胰岛的葡萄糖刺激的胰岛素分泌,这表明 EA 直接作用于胰腺 β 细胞以发挥抗糖尿病活性,从而刺激胰岛素分泌并减少葡萄糖耐受不良 [ 93 ]。组织病理学结果表明,Uro A 对 β 细胞具有保护作用,例如改善胰腺结构和增加胰岛大小和数量。Uro A 治疗后 DM 小鼠胰腺的超微结构损伤,包括 ER 扩张、线粒体肿胀、嵴骨折和髓鞘形成,也得到了显着改善 [ 90]。我们之前还讨论过,Uro A 通过激活自噬和调节 AKT/mTOR 信号来预防 T2DM 模型小鼠的 β 细胞凋亡 [ 88 , 90 , 102 ]。然而,Uro A 改善 β 细胞结构和功能以降低 DM 风险的具体机制需要进一步探索。
总之,本节广泛讨论了 Uro A 在改善胰腺疾病中的代谢和作用(总结在图 2中)。通过阐明 Uro A 的体内代谢和 Uro A 保护胰腺的机制,它可能为通过富含 ET 和 EA 的植物性食物管理胰腺损伤提供新的思路。
This entry is adapted from the peer-reviewed paper 10.3390/nu14122549
This entry is offline, you can click here to edit this entry!
