Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Biochemistry & Molecular Biology
폐암은 암 관련 사망의 주요 원인입니다. 소세포폐암(SCLC)
은 전체 폐암의 15~25%를 차지합니다. 그것은 빠른 배가 시간과 높은 수준의
침습성을 나타냅니다. 또한, c-Kit의 과발현은 SCLC 환자의 70%에서 발생합니다. 본 연구에서는 SCLC
의 잠재적 치료제인 c-Kit을 표적으로 하는 항체-약물 접합체(ADC)를 평가하였다 .
먼저, 우리는 c-Kit을 표적으로 하는 완전한 인간 항체인 4C9를 생성하고 특성화했으며,
결합 친화도는 KD = 5.5 × 9 M인 c-Kit을 발현하는 SCLC 세포에 특이적으로 결합합니다.
그런 다음, DM1을 사용하여 ADC를 개발했습니다. 페이로드로서의 미세소관 억제제. 4C9-DM1 효율적으로
158 pM에서 4 nM 범위의 IC50으로 SCLC에서 세포자멸사를 유도했습니다. 이종이식 마우스 모델 을 사용한 생체내 분석 은 4C9-DM1 단독에 대해
45%(3mg/kg) 및 59%(5mg/kg)의 종양 성장 억제(TGI) 비율 을 나타냈습니다.
4C9-DM1 + 카르보플라틴/에토 포시드
또는 루르비넥티드의 조합 치료는 비히클 대조군과 비교하여 90% 초과의 TGI 비율을 초래했습니다. 종합
하면, 이러한 결과는 4C9-DM1이 SCLC 치료를 위한 잠재적 치료제임을 나타냅니다.
- c-Kit
- small cell lung cancer
- monoclonal antibody
- antibody-drug conjugate
1. 소개
폐암은 서구 세계에서 암 관련 사망의 주요 원인이며 소세포폐암(SCLC)과 비소세포폐암(NSCLC)의 두 그룹으로 분류됩니다[ 1 ]. 신경 내분비 종양인 SCLC는 빠른 종양 성장, 높은 수준의 침습성 및 광범위한 전이의 조기 발달에 의해 NSCLC와 구별됩니다[ 2 ]. SCLC는 질병 진행, 예후 및 병인과 관련하여 폐외 소세포 암종과 분명히 다릅니다[ 3 ]. 적절한 치료가 없으면 SCLC 환자의 기대 수명은 4개월 미만입니다. 5년 상대생존율이 지난 수십 년 동안 7% 향상되었지만 여전히 매우 열악합니다[ 4 ].
다양한 분자 마커가 SCLC 의 발병기전과 예후와 관련이 있습니다[ 5,6 ] . 측분비 또는 자가분비 신호 전달 경로는 조절되지 않은 SCLC 성장을 설명하는 데 널리 사용됩니다[ 6 ]. 또한, 종양 단백질 p53, 망막모세포종 단백질, NOTCH, MYC 및 포스파티딜이노시톨 3-키나제(PI3K)는 SCLC에서 비정상적으로 돌연변이됩니다. 그러나 NSCLC에서 발생하는 EGFR 돌연변이와 같은 잘 확립된 병인학적 요인은 확인되지 않았습니다[ 7 , 8 , 9 , 10 ]. SCLC는 매우 공격적인 경과를 보이며 게놈 불안정성, 증가된 혈관성 및 높은 전이 가능성을 특징으로 합니다[ 11]. 결과적으로, 대부분의 SCLC 환자는 진단 당시 이미 흉부 외부에 전이성 질환이 존재하여 조기 사망을 초래한다[ 12 ]. 또한 대부분의 SCLC 환자는 현재 또는 과거에 심한 흡연을 했으며 이는 높은 종양 돌연변이 부담과 관련이 있으며 C:G > A:T 변환이 가장 흔한 염기 치환 유형입니다[ 13 , 14 ]
c-Kit 원종양유전자는 혈소판 유래 성장 인자 수용체(PDGFR) 패밀리에 속하는 막횡단 티로신 키나제 성장 인자 수용체를 인코딩합니다[ 15 , 16 ]. 리간드 줄기 세포 인자(SCF)는 여러 조혈 줄기 세포의 증식을 촉진하는 조혈 성장 인자입니다[ 17 , 18 ]. 또한 c-Kit 활성은 다양한 암에서 조절되지 않습니다[ 19 , 20 ]. 이전 연구에서는 발암성 돌연변이를 포함하는 c-Kit의 발현이 다양한 암에서 조절 이상 및/또는 상향 조절되어 SCF 독립적인 c-Kit 활성화 및 공격적인 형태의 암을 유발한다고 보고했습니다. [ 20]. 흥미롭게도 다양한 증거는 SCLC 세포주와 종양이 c-Kit 수용체와 SCF mRNA를 모두 발현한다는 것을 나타내며, 이는 이러한 유전자 산물이 종양 세포 생존과 성장을 매개하는 자가분비 루프를 구성한다는 것을 시사합니다[ 21 , 22 ]. SCLC는 흡연과 유의한 상관관계가 있지만 발암성 c-Kit 돌연변이는 포함하지 않습니다. 면역조직화학염색에서 c-Kit의 과발현은 SCLC 환자의 70%에서 발생하는 것으로 나타났습니다[ 23 , 24 ]. BCR-ABL, 혈소판유래성장인자수용체(PDGFR), c-Kit 등을 표적으로 하기 위해 개발된 이마티닙은 현재 만성골수성백혈병, 급성림프성백혈병, 위장관기질종양(GIST), 과호산구성 증후군 치료제로 사용되고 있다. 25 ,26 , 27 , 28 ]. 다양한 시험관 내 및 생체 내 연구에서 이마티닙이 SCLC에 대한 치료 효능을 나타내는 것으로 나타났습니다[ 29 , 30 ]. 그러나 임상 2상에서 이마티닙은 객관적인 반응이 부족하여 유의한 치료 효능을 나타내지 못 하였다 [ 31,32,33 ] . 따라서 SCLC에서 표적 c-Kit에 대한 대안적 접근이 필요합니다.
2. 4C9 항체는 c-Kit에 특이적으로 결합합니다.
먼저 4C9 항체가 세포 표면의 c-Kit에 특이적으로 결합하는지 여부를 조사했습니다. FACS 분석은 4C9가 NCI-H526, NCI-H1048 및 NCI-H889를 비롯한 다양한 SCLC 세포주에 용량 의존적 방식으로 결합함을 보여주었다( 도 1A). 흥미롭게도, 4C9 항체 결합은 c-Kit-양성 SCLC 세포주에서 50ng/mL로 포화되었습니다. 또한, c-Kit의 발현은 NCI-H526 및 NCI-H1048 세포에 비해 NCI-H889 세포에서 더 높았는데, 이는 이전 보고서와 일치한다[ 34]. 그러나, 4C9는 c-Kit 음성 SCLC 세포주인 NCI-H446 및 NCI-H2170 세포와 교차 반응성을 나타내지 않았다. 우리는 siRNA 녹다운 실험을 사용하여 c-Kit에 대한 4C9의 특이적 결합을 추가로 조사했습니다. 웨스턴 블롯 분석은 c-Kit siRNA가 NCI-H1048 세포에서 단백질 발현을 효율적으로 감소시키는 것으로 나타났습니다( 그림 1B). FACS 분석은 세포 표면의 c-Kit 발현도 c-Kit siRNA에 의해 하향 조절된다는 것을 보여주었습니다. 종합하면, 4C9는 세포 표면에 있는 c-Kit의 세포외 도메인에 특이적으로 결합합니다.
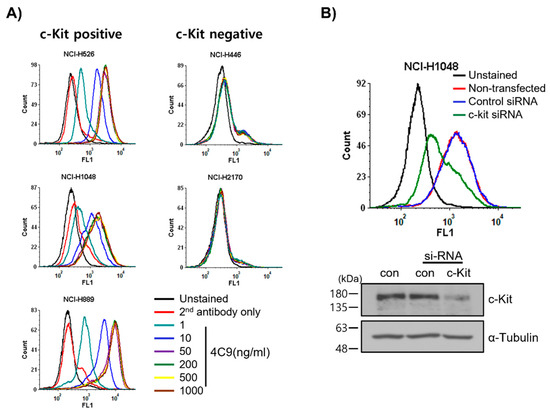
그림 1. SCLC 세포 표면에 대한 4C9 항체의 특이적 결합 측정. ( A ) SCLC 세포주를 용량 의존적 방식으로 4C9 항체와 함께 인큐베이션하고 FACS에 의해 분석하였다. ( B ) NCI-H1048 세포를 대조군 또는 c-Kit si-RNA로 형질감염시키고 72시간 동안 인큐베이션하였다. NCI-H1048 세포에 대한 4C9(1㎍/mL)의 결합을 FACS에 의해 결정하였다. c-Kit 단백질 발현의 si-RNA 매개 하향 조절은 웨스턴 블롯 분석에 의해 평가되었다. 알파 튜불린을 로딩 대조군으로 사용했습니다.
다음으로 우리는 4C9 항체가 c-Kit의 리간드인 SCF의 결합을 억제할 수 있는지 조사했습니다. Competitive enzyme-linked immunosorbent assay(ELISA) 결과는 c-Kit에 대한 4C9 항체의 결합이 고농도에서도 SCF의 영향을 받지 않는 것으로 나타났으며( 그림 2A), 이는 4C9 항체가 SCF와 무관하게 c-Kit에 결합함을 시사합니다. 또한 4C9가 c-Kit의 SCF 매개 인산화를 억제할 수 있는지 여부를 평가했습니다. GIST-T1 세포를 사용하여 4C9 항체로 전처리하면 용량 의존적으로 c-Kit 인산화가 감소되었습니다. 그러나 c-Kit의 하류 분자인 ERK 및 Akt의 인산화 수준은 4C9 항체 처리에 의해 변경되지 않았습니다( 그림 2B). 흥미롭게도, 총 c-Kit 수준은 4C9 항체 치료에 의해 감소했습니다(그림 2 B). 따라서 인산화된 c-Kit 수준의 감소는 c-Kit의 발현 감소로 인해 발생할 수 있습니다. c-Kit의 안정성 평가는 4C9 항체가 GIST 세포주와 일부 SCLC 세포주 모두에서 시간 의존적 방식으로 총 c-Kit 수준을 극적으로 감소시켰으며, 이는 유비퀴틴화 의존적 분해와 관련될 수 있음을 나타냅니다. 그럼에도 불구하고 이것은 더 많은 설명이 필요합니다. GIST-T1과 달리 4C9는 NCI-H526 및 NCI-H1048 세포주에서 SCF 매개 c-Kit 인산화 또는 c-Kit 안정성을 감소시키지 않았습니다( 그림 2C ). 또한, 4C9 항체는 SCF에 의해 유도된 ERK 및 Akt의 인산화를 억제하지 않았으며, 이는 4C9 항체가 SCF/c-Kit 신호전달의 길항제로서 기능하지 않음을 시사한다.
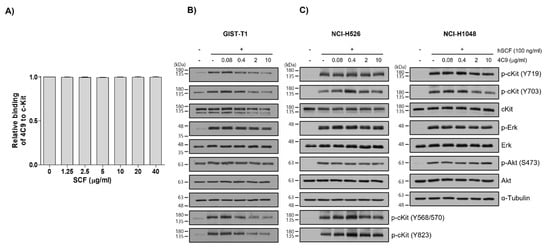
그림 2. 4C9 항체의 특성화. ( A ) 인간 c-Kit (20 ng/웰)을 96-웰 플레이트에 코팅하고 4C9 항체의 결합을 표시된 농도의 인간 SCF 존재 하에 조사하였다. 결과는 3개의 독립적인 실험의 평균 ± SD를 나타냅니다. ( B , C ) GIST-T1, NCI-H526 또는 NCI-H1048 세포를 SCF(100ng/mL)의 존재 또는 부재 하에 표시된 농도에서 4C9로 처리하였다. c-Kit, Akt 및 ERK의 인산화는 웨스턴 블롯 분석으로 평가되었습니다. NCI-H1048 세포에서 SCF 처리에 의한 Y568/570 및 Y823의 인산화는 검출되지 않았다. 알파 튜불린을 로딩 대조군으로 사용했습니다. 결과는 3개의 독립적인 실험의 평균 ± SD를 나타냅니다.
3. ADC 생성 및 특성화(4C9-DM1)
c-Kit이 SCLC 세포주에서 과발현되더라도 SCLC의 발병기전과 imatinib의 실패에서 SCF/c-Kit 신호전달의 제한된 기여로 인해 네이키드 항체를 SCLC 치료에 적용할 수 없습니다[ 32 , 33 ]. 따라서 ADC의 개발은 SCLC를 효과적으로 치료하기 위한 합리적인 선택이 될 것입니다. ADC를 생성할 때 고려해야 할 중요한 요소 중 하나는 표적 분자와 항체가 복합적으로 형성된 후 내재화 효율입니다. 따라서 우리는 먼저 4C9 항체가 SCLC 세포주에서 내재화되는지 여부를 조사했습니다. FACS 분석은 4C9 항체의 내재화 효율이 NCI-H526에서 91%, NCI-H1048에서 76.6%, NCI-H889 세포에서 68.6%임을 나타내었다( 도 3A) 이는 4C9 항체가 SCLC를 치료하기 위한 독소의 특이적 전달을 위한 효율적인 운반체로 사용될 수 있음을 시사합니다. 다음으로, 우리는 noncleavable linker와 microtubule inhibitor로 구성된 SMCC-DM1을 사용하여 ADC를 생성했습니다. DM1은 252 nm에서 자외선을 흡수하기 때문에[ 35 ], 252 nm에서 네이키드 항체(4C9) 및 ADC(4C9-DM1)의 흡광도를 분석했습니다. 4C9-DM1의 흡광도는 252 nm에서 4C9의 흡광도보다 높았습니다( 그림 3B ). 약물-항체 비율(DAR)은 이전에 설명한 대로 결정되었습니다[ 36] 및 DAR은 약 2.16이었습니다. SDS-PAGE 분석은 4C9 항체에 대한 SMCC-DM1의 접합이 약간의 크기 이동을 초래하는 것으로 나타났습니다. SMCC 링커의 N-히드록시숙신이미드 에스테르는 항체 내 라이신 잔기의 1차 아민과 반응하기 때문에 ADC의 표적 결합 친화도에 영향을 미칠 수 있다. ELISA는 c-Kit에 대한 4C9 및 4C9-DM1의 결합 친화도가 유사함을 입증했습니다(도 3C ) . 표면 플라즈몬 공명(SPR)을 사용한 결합 친화도의 정량적 분석은 인간 c-Kit에 대한 4C9의 결합 친화도가 5.5 × 10 -9 M(Ka = 2.27 × 10 4 M -1 s -1 및 Kd = 1.27 )임을 나타내었다. × 10 -4 초 -1), 그리고 4C9-DM1도 유사한 결합 친화도를 보였다(5.46 × 10 -9 M; Ka = 2.14 × 10 4 M -1 s -1 및 Kd = 1.16 × 10 -4 s -1 )( 그림 3D). 종합하면, 이러한 결과는 4C9 항체에 SMCC-DM1을 사용한 접합이 c-Kit에 대한 4C9 항체의 결합 친화도에 영향을 미치지 않았음을 나타냅니다.
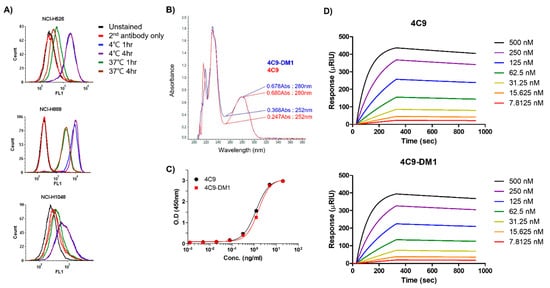
그림 3. 4C9-DM1의 특성화. ( A ) 다양한 SCLC 세포주로의 4C9 항체의 내재화는 FACS 분석을 사용하여 결정되었습니다. SCLC 세포를 사이클로헥시미드(75μg/mL)와 함께 인큐베이션하고 Fc 수용체 매개 내재화를 억제하기 위해 10분 동안 Fc 차단제로 차단했습니다. SCLC 세포를 4C9 항체의 존재 또는 부재하에 4°C 또는 37°C에서 1-4시간 동안 배양하고 유세포 분석을 실시했습니다. 세포 표면의 4C9/c-Kit 복합체의 형광 신호는 37°C에서 배양 후 감소했습니다. ( B ) 252 nm에서 네이키드 4C9 항체의 광학 흡광도와 비교한 4C9-DM1의 광학 흡광도. c-Kit에 대한 4C9 및 4C9-DM1의 결합 친화도를 ELISA( C ) 및 SPR( D )을 사용하여 비교하였다.
4. 4C9-DM1은 시험관내 및 생체내에서 항종양 활성을 나타낸다
다음으로 다양한 SCLC 세포주(NCI-H526, NCI-H889, NCI-H1048, NCI-H446, NCI-H2170)와 유방암 세포주(MDA-MB-453)를 사용하여 in vitro 세포독성을 분석하였다. c-Kit 음성 세포주(NCI-H446, NCI-H2170 및 MDA-MB-453)를 음성 대조군으로 사용했습니다. 4C9-DM1은 NCI-H526, NCI-H889, 및 NCI-H1048에 대해 시험관내 세포독성 을 158 pM 내지 4 nM 범위 의 최대 억제 농도(IC 50 ) 값으로 나타내었다. c-Kit-양성 암 세포주에 대한 4C9-DM1의 시험관 내 세포독성 활성은 c-Kit-음성 암 세포주에 대한 것보다 4배에서 >300배 더 높았습니다( 그림 4A,B 및 표 1). 흥미롭게도, c-Kit-양성 암 세포에 대한 DM1의 세포독성 활성은 페이로드 단독보다는 ADC로 적용될 때 7배에서 >77배 더 높았다. 대조적으로, 그것의 세포독성 활성은 c-Kit-음성 암 세포에 대해 2-5배 더 낮았으며( 표 1 ), ADC로 페이로드를 포함하면 표적 외 독성을 줄일 수 있음을 시사합니다. DM1은 미세소관의 조립을 억제하여 G2/M 단계에서 세포 주기 정지를 유도하여 활발하게 분열하는 세포의 아폽토시스를 유발합니다. 따라서 우리는 c-Kit 양성 SCLC 세포주인 NCI-H526과 c-Kit 음성 SCLC 세포주인 NCI-H446을 사용하여 4C9-DM1이 세포 주기에 미치는 영향을 분석했습니다. 그림 4 와 같이C, 4C9-DM1은 시간 의존적 방식으로 G2/M기의 세포 집단을 유의하게 증가시켰지만 4C9 및 IgG-DM1은 그렇지 않았다. 또한, 4C9, 4C9-DM1 및 IgG-DM1은 c-Kit 음성 NCI-H446 세포에서 G2/M기의 세포 집단을 변경하지 않았으며, 이는 NCI-H526 세포에서 세포 주기 정지가 DM1에 의해 특이적으로 매개됨을 시사합니다 4C9-DM1 및 c-Kit으로 복잡한 형성으로 전달됩니다.
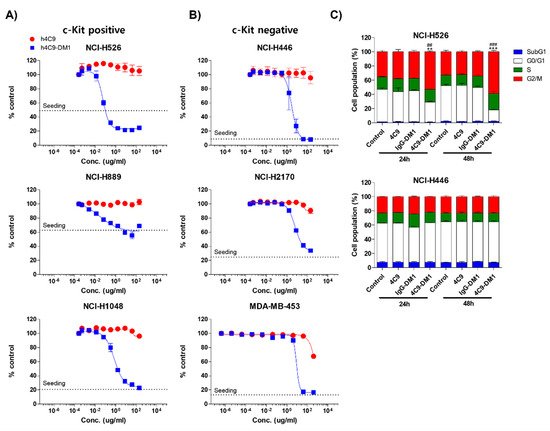
그림 4. 4C9-DM1은 시험관 내 SCLC 세포에 대한 세포 독성을 나타냅니다. ( A , B ) c-Kit 양성 또는 음성 SCLC 세포주를 96웰 플레이트에 접종하고 3-5일 동안 용량 의존적 방식으로 4C9 또는 4C9-DM1과 함께 배양했습니다. 살아있는 세포를 Hoechst 33342(10μM)로 37°C에서 30분 동안 염색하고 Celigo Imaging Cytometer를 사용하여 정량화했습니다. 4C9-DM1 처리는 용량 의존적 방식으로 세포 생존력을 감소시켰다. 결과는 최소 3번의 독립적인 실험의 평균 ± 표준 오차를 나타냅니다. ( C) 4C9-DM1은 G2/M 단계에서 세포 주기 정지를 유도했습니다. SCLC 세포주를 96웰 플레이트에 접종하고 4C9(1μg/mL), IgG-DM1(1μg/mL) 또는 4C9-DM1(1μg/mL)과 함께 24시간 및 48시간 동안 인큐베이션했습니다. 그런 다음, 세포를 propidium iodide로 염색하고 Celigo Imaging Cytometer를 사용하여 분석했습니다(** 및 *** 대 대조군; ## 및 ### 대 IgG-DM1). 결과는 최소 3번의 독립적인 실험의 평균 ± 표준 오차를 나타냅니다. 결과는 평균 ± 평균의 표준 오차로 표시됩니다. 평균은 짝을 이루지 않은 스튜던트의 양측 t-검정 을 사용하여 비교되었습니다 . ** p < 0.01, *** p < 0.001, ## p < 0.01, ### p < 0.001.
표 1. 시험 물질의 IC 50 (nM) 값.
| c-키트 표현 | 조직 유형 | 세포주 | 4C9-DM1 * | SMCC-DM1 |
|---|---|---|---|---|
| c-키트 양성 | SCLC | NCI-H526 | 0.158 | 12.23 |
| NCI-H889 | 0.323 | 11.62 | ||
| NCI-H1048 | 4.08 | 30.45 | ||
| c-키트 네거티브 | SCLC | NCI-H446 | 16.58 | 6.97 |
| NCI-H2170 | 35.5 | 20.17 | ||
| 유방암 | MDA-MB-453 | 47.63 | 9.763 |
* 몰 농도는 4C9-DM1의 분자량에 대해 180kDa로 계산되었습니다.
시험관내 세포독성 검정에 기초하여, 4C9-DM1의 생체내 효능을 NCI-H526으로 이종이식된 마우스 모델을 사용하여 조사하였다. IgG-DM1은 효과를 나타내지 않았지만, 4C9-DM1은 용량 의존적 방식으로 NCI-H526 종양 성장을 유의하게 억제하였다( 도 5A ). 1, 3 및 5 mg/kg의 용량에서 4C9-DM1의 종양 성장 억제(TGI) 비율은 비히클 대조군과 비교하여 각각 40%, 45% 및 59%였습니다. 4C9 항체 단독으로는 종양 성장을 부분적으로 억제했지만 이 효과는 통계적으로 유의하지 않았다. 투여된 물질로 인한 체중 감소는 관찰되지 않았다( 그림 5A) 독성과 관련된 우려가 없음을 시사한다. etoposide, cisplatin, carboplatin 및 lurbinectin을 포함한 화학 요법은 표준 치료로 SCLC 환자를 치료하는 데 사용됩니다[ 37 , 38 ]. 화학요법제를 이용한 병용 요법이 효과적이지만 대부분의 SCLC는 1년 이내에 빠르게 재발한다[ 39 ]. 따라서 우리는 4C9-DM1과 화학 요법의 조합이 SCLC의 치료 효능을 향상시킬 수 있는지 여부를 결정했습니다. 그림 5 와 같이B, 4C9-DM1, lurbinectin 및 carboplatin/etoposide는 유사한 항종양 활성을 나타내었고; 이들 그룹의 TGI 비율은 비히클 대조군과 비교하여 18일째에 50%였다. 흥미롭게도, 4C9-DM1과 lurbinectin 또는 carboplatin/etoposide의 조합은 상승적으로 종양 성장을 억제했습니다. 두 그룹의 TGI 비율은 85%였으며, 이는 후속적인 재성장이 있는 18일째의 비히클 대조군의 TGI 비율과 비교됩니다. 4C9-DM1과 lurbinectin을 병용한 치료는 약 10%의 체중 감소를 유도했습니다. 그러나 체중은 치료 중단 후 다시 증가했습니다( 그림 5B ). 이것은 이 조합이 관리 가능하거나 약한 독성으로 SCLC를 치료하는 데 사용될 수 있음을 시사합니다.
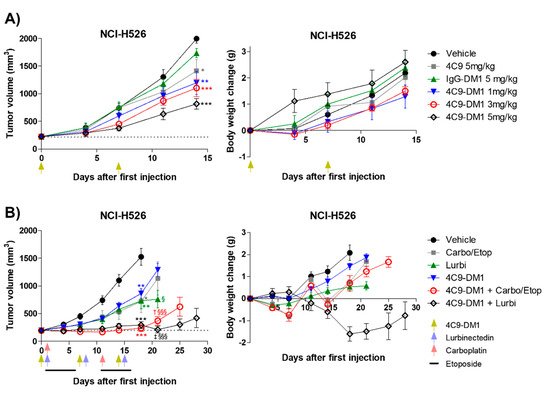
그림 5. 4C9-DM1은 이종이식 마우스 모델에서 SCLC 종양 성장을 억제합니다. ( A , B ) 4C9-DM1의 항종양 활성을 생체내 이종이식 마우스 모델에서 평가하였다. 방법 섹션에 설명된 대로 NCI-H526 암세포를 면역 결핍 마우스에 이식했습니다. 종양 부피가 ~200 mm 3 ( n= 6). 동물에게 비히클, 4C9, IgG-DM1 또는 4C9-DM1을 정맥내 투여하였다. Carboplatin(1일 및 11일에 60mg/kg) 및 etoposide(1-5일 및 11-15일에 3mg/kg)를 복강 내 투여하거나 4C9-DM1과 조합했습니다. 추가로, lurbinectin(1일, 8일 및 15일에 0.08 mg/kg)을 정맥내 투여하거나 지시된 대로 4C9-DM1과 조합했습니다. 녹색 화살표는 비히클, IgG-DM1, 4C9 또는 4C9-DM1의 투여를 나타내고 파란색 및 빨간색 화살표는 각각 루르비넥틴 및 카보플라틴의 투여를 나타냅니다(*, ** 및 *** 대 각각의 해당 비히클 대조군 § 및 §§§ 대 각각 해당하는 4C9-DM1 대조군 † 대 카르보플라틴/에토 포시드 ‡대 루비넥티드). 결과는 평균 ± 평균의 표준 오차로 표시됩니다. 평균은 짝을 이루지 않은 스튜던트의 양측 t-검정 을 사용하여 비교되었습니다 . * p < 0.05, ** p < 0.01, *** p < 0.001, † p < 0.05, ‡ p < 0.01, § p < 0.05, §§§ p < 0.001.
This entry is offline, you can click here to edit this entry!
