The flaviviruses are important human pathogens, and a deeper understanding of the virus–host cell interaction is required to identify cellular targets that can be used as therapeutic candidates. Flaviviruses hijack several cellular functions, such as exosome-mediated cell communication during infection, which is modulated by the delivery of the exosomal cargo of pro- or antiviral molecules to the receiving host cells. Therefore, to study the role of exosomes during flavivirus infections is essential to identify molecular factors that may contribute to the development of new strategies to block viral infections. This review explores the implications of exosomes in flavivirus dissemination and transmission from the vector to human host cells, as well as their involvement in the host immune response. Although several studies have been performed to identify and characterize cellular and viral molecules released in exosomes, the role of these components in viral pathogenesis is unclear. Further studies will determine the balance between protective and harmful exosomes secreted by flavivirus infected cells, the characteristics and components that distinguish them both, and how they could be a factor that determines the infection outcome.
1. Definición
Los flavivirus transmitidos por artrópodos son importantes patógenos humanos, y se requiere una comprensión más profunda de la interacción virus-célula huésped para identificar objetivos celulares que pueden usarse como candidatos terapéuticos. Está bien informado que los flavivirus secuestran varias funciones celulares, como la comunicación celular mediada por exosomas durante la infección, que se modula mediante la entrega de la carga exosómica de moléculas pro o antivirales a las células huésped receptoras. Por lo tanto, estudiar el papel de los exosomas durante las infecciones por flavivirus es esencial, no solo para comprender su relevancia en la interacción virus-huésped, sino también para identificar los factores moleculares que pueden contribuir al desarrollo de nuevas estrategias para bloquear estas infecciones virales.
2. Introducción
Los flavivirus, como el dengue (DENV), el zika (ZIKV), la encefalitis transmitida por garrapatas (TBEV) y los virus del Nilo Occidental (WNV), que se transmiten por mosquitos o garrapatas, causan una amplia gama de síntomas, como parálisis, fiebre, meningitis, shock, anomalías congénitas y muerte [ 1 , 2 , 3 , 4 , 5 ]. Por lo tanto, la replicación viral exitosa requiere el secuestro de vías celulares clave dentro de las células huésped [ 6 , 7] Una de ellas es la comunicación de célula a célula a través de la vía exosómica, donde los exosomas liberados de las células infectadas por el huésped humano y el vector de artrópodos con flavivirus contienen un amplio conjunto de factores celulares virales y del huésped que pueden modificar las respuestas de las células receptoras [ 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 ].
Los exosomas tienen un lugar especial entre las vesículas extracelulares (EV) ya que son diferentes en tamaño y origen [ 17 ] a otras vesículas. Los exosomas son nanovesículas de 30 a 150 nm generadas por la vía endosómica de las vesículas intraluminales (ILV) dentro de los cuerpos multivesiculares (MBV) [ 17 , 18 , 19 ]. Por el contrario, los otros EV, como los cuerpos apoptóticos (AB) y las microvesículas, pueden medir hasta 5000 nm y 1000 nm, respectivamente [ 20 , 21 ]. Además, en el caso de los AB, la formación de EV se produce durante la desintegración apoptótica, o las microvesículas brotan directamente de la membrana plasmática [ 20 , 21] Se ha descrito que los exosomas tienen una carga que puede consistir en ARN, miARN, proteínas u otras moléculas que modulan la comunicación celular, lo que desencadena cambios en las células objetivo durante los mecanismos fisiológicos y la enfermedad como infecciones virales [ 22 , 23 , 24 , 25 , 26 ]. Además, los exosomas están enriquecidos en colesterol [ 27 , 28 ], una molécula esencial en la replicación de flavivirus [ 29 ].
Como consecuencia, los estudios de exosomas liberados de las células huésped y vector infectadas por flavivirus han demostrado poblaciones altamente específicas con un repertorio molecular que determina su papel en la comunicación intracelular, la diseminación viral y la respuesta inmune del huésped [ 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 30 ].
3. El papel de los exosomas en la respuesta inmune del huésped durante la infección por flavivirus
Durante la infección por flavivirus, se activa una potente respuesta antiviral para evitar la replicación del virus y propagarse a las células vecinas en el huésped humano [ 52 , 53 , 54 ]. Esta respuesta antiviral se desencadena por los receptores de reconocimiento de patrones (PRR), como los receptores tipo Toll (TLR), los receptores similares a los dominios de oligomerización de nucleótidos (NOD) y el gen I inducible por retinoides (RIG-I) similares a los receptores (RLR), que reconocen el ARN del flavivirus y activan los factores de transcripción IRF3, IRF7 y NF-kB a través de las vías de señalización para la producción de interferones tipo I (IFN-α y β) y citocinas proinflamatorias [ 53 , 55] El IFN-α y β producidos se liberan de la célula al torrente sanguíneo y, una vez en la superficie de las células objetivo, se unen al receptor IFN-α / β (IFNAR) y activan la cascada de señalización JAK / STAT, lo que lleva a la transcripción de cientos de genes estimulados por IFN (ISG) con actividad anti-flavivirus [ 54 , 56 , 57 , 58 ]. Por lo tanto, la comunicación de célula a célula en respuesta a la infección por flavivirus está mediada por la secreción de IFN tipo I [ 53 ]. Sin embargo, los exosomas pueden estimular la respuesta inmune como un nuevo mecanismo de señalización / comunicación celular durante las diferentes infecciones por flavivirus.
3.1. DENV
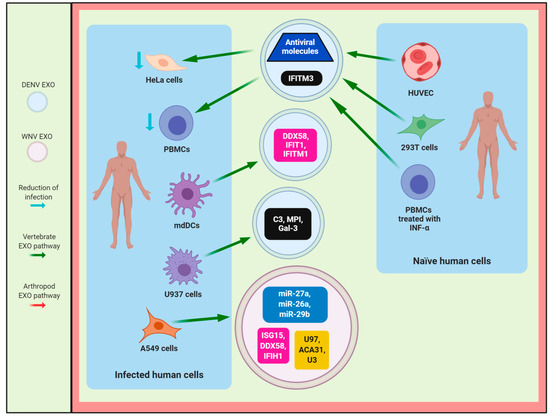
La proteína transmembrana inducible por IFN 3 (IFITM3), un mediador requerido para la respuesta anti-flavivirus de IFN [ 59 , 60 , 61 ], se encuentra en exosomas derivados de células HUVEC ingenuas y de riñón embrionario humano 293 (293T), que tienen actividad antiviral en células HeLa infectadas con DENV2, como se muestra en la [ 30 ]. Además, Zhu et al. sugieren que los exosomas que contienen IFITM pueden transferirse a células que no están directamente estimuladas con IFN, lo que lleva al establecimiento de un estado antiviral, como se muestra en la [ 30 ].
Figura 5. El papel protector de los exosomas / EV durante la infección por flavivirus. Exosomas / EV de infectados con flavivirus, vírgenes o tratados con células humanas INF-α que contienen sncRNA (recuadro amarillo), miRNA (recuadro azul), mRNA (recuadro rosa) y proteínas (recuadro negro), que están implicados en la reducción de la infección en células humanas Abreviaturas: HUVEC, células endoteliales de la vena umbilical humana; mdDC, células dendríticas derivadas de monocitos humanos; Células HeLa, células de cáncer cervical; PBMC, células mononucleares de sangre periférica humana; Células U937, macrófagos U937 adherentes humanos; Células A549, células de carcinoma alveolar humano; Células 293T, células de riñón embrionario humano.
Las células dendríticas (DC) son células profesionales presentadoras de antígeno (APC), fagocitos potentes [ 62 ] y objetivos biológicos críticos de infección por flavivirus [ 63 ]. En este sentido, los EV liberados de mdDC infectados con DENV3 5532 (fenotipo de infección grave) contienen miRNA asociados con la infección por DENV, como let-7e, mir-1246, mir-1261, mir-142, mir-371b, mir-3937, y mir-4327, como se muestra en la [ 9] Curiosamente, let-7e, mir-1261, mir-371b y mir-4327 se encontraron en EV derivados de mdDC infectados con la cepa hemorrágica DENV3-5532, pero no en células infectadas con la cepa leve DENV3-290 (aislada de un caso leve de dengue). Por lo tanto, estos miARN podrían ser biomarcadores circulantes adecuados de la gravedad de la enfermedad del dengue, como se muestra en la [ 9 ], como lo sugieren Mishra et al. [ 64 ] Los miRNA son un tipo de ARN pequeño no codificante que puede regular la expresión génica para modular diferentes procesos biológicos [ 65] Let-7e tiene actividad pro-viral porque puede inhibir la expresión de TNF-α a través de su objetivo directo potencial al potenciador del gen homólogo de Zeste 2 (EZH2) en células mononucleares de sangre periférica humana (PBMC) infectadas con DENV2 [ 66 ]. Por el contrario, algunos miRNA encontrados en EV secretados por mdDC infectados con DENV3 tienen actividades antivirales, tales como: el miR-1246 que regula la señalización de NF-kB para aumentar la respuesta proinflamatoria [ 67 ]; el mir-142 que puede insertarse en el genoma DENV2 para restringir la replicación de flavivirus en DC y macrófagos [ 68 ]; La expresión de mir-3937 y mir-4327 podría participar en respuesta a la infección por flavivirus [ 69 , 70 ].
Martins y col. sugieren que los miRNA que se identificaron en EV de mdDC infectados con DENV3-5532 regulan el factor de crecimiento transformante beta (TGF-β), Erb, MAP quinasas (MAPK), fosfatidilinositol-3-quinasa / serina-treonina quinasa (PIK3 / AKT ) y vías de fosfatidilinositol [ 9 ]. Por lo tanto, la interferencia de las vías PIK3 / AKT y TGF-β podría facilitar la apoptosis de DC y un entorno proinflamatorio durante la infección por DENV3-5532 [ 9 , 71 ]. Además, varios miRNA presentes en los EV liberados de mdDC infectados con DENV3-5532 pueden interferir con la vía de vigilancia de mRNA que degrada el ARN viral, que puede estar asociado con la gravedad del dengue [ 9 , 71] Además, se ha informado que los ARNm encontrados en EV derivados de mdDC infectados con DENV3-5532 están involucrados en la activación de las vías de respuesta inmune de los linfocitos T y B y DC, como se muestra en la [ 9 ]. Por otro lado, los ARNm derivados de EV producidos a partir de mdDC infectados con DENV3-290 tienen un efecto inhibitorio sobre la respuesta inmune de DC [ 9 ].
El hallazgo interesante en el estudio de Martin et al. fue que los EV, liberados por mdDC infectados con DENV3-5532, contienen ARNm de citocinas, como CXCR4, factor inhibidor de la migración de macrófagos (MIF), IL-17A e IL-8, involucrados en la gravedad de la enfermedad en pacientes con dengue y plaquetas y activación de células endoteliales y citocinas asociadas con pérdida de plasma y síndrome de choque por dengue, como IL-6, que coincide con las manifestaciones hemorrágicas en pacientes infectados con DENV3-5532 [ 9 ]. El CXCR4 podría considerarse un factor pro-viral ya que su antagonismo aumenta el tráfico de células T en el sistema nervioso central, lo que lleva a una reducción de las cargas virales y una disminución de la inmunopatología en este sitio durante la encefalitis por flavivirus [ 72]] En este sentido, la citocina proinflamatoria MIF también es un factor pro-viral porque esta molécula favorece la neuroinvasión viral al comprometer la integridad de la barrera hematoencefálica en la infección por flavivirus [ 73 ]. Además, otros ARNm, tales como helicasas dependientes de ATP (DDX58, DDX60 y DDX60L), quimiocinas (CXCL10 y CXCL11) y efectores de la respuesta IFN tipo I (IFI35, IFI44L, IFIT1, IFIT5, IFIT3 e IFITM1) fueron encontrado en EV producidos a partir de mdDC infectados con DENV3-5532, como se muestra en la y [ 9 ]. Por lo tanto, los EV podrían considerarse biomarcadores valiosos para predecir los resultados clínicos de la infección por flavivirus [ 9 , 71 , 74 ].
Además, los EV aislados de PBMC tratados con IFN-α pueden inhibir la infección por DENV3-5532 en PBMC, lo que sugiere que los EV podrían ser una vía de comunicación entre las células inmunes para compartir señales de defensa durante la infección por flavivirus para inhibir la replicación viral y reducir la infección viral, como se muestra en y [ 9 ]. En este sentido, Slonchak et al. sugieren que la infección por flavivirus y el tratamiento con IFN-α estimulan predominantemente los miRNA, como miR-27a, miR-26a, miR-29B, miR-3614 y miR-664a, y su incorporación a los EV, que pueden regular los genes del huésped involucrados en la respuesta inmune, como se muestra en la y la [ 11] Sin embargo, la infección por flavivirus induce cambios más profundos en la abundancia de los sncRNAs y mRNAs presentes en los EV, en contraste con los EV derivados de células vírgenes tratadas con IFN [ 11 ]. Además, los ARNm (IFNB1, IFNL2, RIG-I (DDX58), TRIM25, MDA5 (IFIH1), IRF1, IRF9, STAT2, ISG15, ISG54 (IFIT2) y OAS1) contenidos en EV de las células A549 infectadas con WNV o inducidos durante la infección por flavivirus están asociados con la respuesta antiviral mediada por la vía de señalización de IFN tipo I, la señalización de Wnt, la cascada de Jak / STAT y la vía de señalización del receptor de células T [ 11 ]. Por el contrario, los ARNm encontrados en los EV liberados por las células tratadas con IFN solo participan en la señalización de Wnt y la vía de señalización de IFN tipo I [ 11]] Curiosamente, los ARN largos (> 300 nt) y pequeños (<300 nt) incorporados en los EV de las células A549 infectadas con WNV, como se muestra en la , pueden inducir la expresión de genes, como MDA5, TRIM25 e ISG15 involucrados en La respuesta inmune innata en las células A549 ingenuas [ 11 ]. Por lo tanto, los exosomas / EV secretados durante la infección por flavivirus podrían contener proteínas, miARN, ARNm y ARN asociados con la respuesta antiviral y transferir la actividad antiviral a las células diana, como se muestra en la .
DENV2 estimula CLEC2 en plaquetas humanas para promover la liberación de EV, lo que induce la formación de NET, deteriora la integridad endotelial y agrava la pérdida de plasma, lo que contribuye a la mortalidad inducida por DENV, como se muestra en la [ 12 ]. Por lo tanto, los EV, CLEC2 y las plaquetas juegan un papel crítico en la patogénesis de las infecciones por flavivirus. Además, Sung et al. demostró que las plaquetas activadas por DENV2 podían liberar EV para mejorar la producción de NET y la liberación de citocinas proinflamatorias (TNF-α e IL-6) a través de CLEC5A (exosomas de DENV2), como se muestra en la , y TLR2 (microvesículas de DENV2) en neutrófilos y macrófagos , apoyando el argumento de que las interacciones entre plaquetas y neutrófilos contribuyen a una reacción inflamatoria mejorada durante la infección por DENV [12 , 75 ]. Por lo tanto, Sung et al. sugieren que DENV puede activar CLEC2 para desencadenar el inflamasoma NALP3 e inducir la liberación de IL-1β de las plaquetas para mejorar la liberación de citocinas proinflamatorias y la formación de NET a través de CLEC5A y TLR2 [ 12 ]. Por lo tanto, la formación de NET inducida por DENV podría aumentar la interacción plaquetas-neutrófilos a través de la liberación de histona 2A y otros componentes nucleares para activar las plaquetas [ 12] Sin embargo, la cantidad de IL-1β producida por las plaquetas es baja en comparación con la producida por los macrófagos, ya que se han reportado altos niveles de IL-1β, IL-18 y la activación del inflamasoma NLRP3 de GM-Mφ (macrófagos inflamatorios ), a través de la activación de caspase-1. Además, se ha descubierto que CLEC5A es esencial para la inducción de NLRP3 en GM-Mφ durante la infección por DENV y la activación de linfocitos TH17, que pueden contribuir a la respuesta inmune del huésped contra el virus [ 76 , 77 ]. Como resultado de eso, la activación de CLEC2 y CLEC5A / TLR2 en las plaquetas y leucocitos por EV contribuye a la gravedad de la enfermedad del dengue y podrían ser un objetivo potencial para inhibir las infecciones por flavivirus [ 12 ].
Por otro lado, los EV liberados de los macrófagos U937 infectados con DENV2 también pueden modular la respuesta endotelial en las células EA.hy926 [ 13 ] porque aumentan la expresión de moléculas de adhesión, como la cadherina endotelial vascular (VE-Cad; major molécula que controla las uniones celulares y la formación de vasos sanguíneos) y la molécula de adhesión intercelular 1 (ICAM-1; molécula endotelial involucrada en la inflamación y la regulación de la permeabilidad vascular) [ 13 ], y la activación y secreción de mediadores inflamatorios, como IL- 8, INF-α, IL-12p70, TNF-α, IL-10 e IP-10, en contraste con las células tratadas con EV de células U937 ingenuas [ 13] Estos EV también contienen miRNA (15-25 nt): miR-4652-3p, miR-4301 y miR-181a-5p con objetivos genéticos relacionados con la adhesión celular y la regulación de la comunicación celular [ 13 ], lo que sugiere que estos miRNA tienen un papel en la activación endotelial y podría regular los genes implicados en la barrera y las funciones estructurales de los vasos en la infección por flavivirus [ 13 ]. Específicamente, el miR-4301 tiene un papel antiproliferativo y pro-apoptótico en el cáncer [ 78 , 79 , 80 ], mientras que miR-181a-5p regula negativamente la respuesta inflamatoria [ 81 , 82 , 83 ] que está involucrada en la activación endotelial durante el DENV infección [ 13] En contraste, algunas proteínas celulares involucradas en la respuesta inmune, como la proteína del complemento C3, el inhibidor de metaloproteinasa (MPI) y la galectina-3 (Gal-3), se encontraron dentro de los EV secretados por los macrófagos infectados con DENV, como se muestra en la [ 13 ]
3.2. ZIKV
Con respecto al ZIKV, los EV de las células de mosquito infectadas con ZIKV pueden inducir la diferenciación y expresión de CD11b + en la superficie de los monocitos [ 8 ]. Además, las células ingenuas de THP-1 activadas por EV liberados de las células de mosquito infectadas muestran un cambio de las células ingenuas a un fenotipo adherente, como ocurre durante la infección por ZIKV [ 8 ]. Por lo tanto, los EV de las células C6 / 36 infectadas con ZIKV pueden activar y diferenciar los monocitos vírgenes.
Además, los EV de las células de mosquito infectadas con ZIKV pueden inducir la expresión de ARNm de TNF-α en células vírgenes THP-1 y HMEC-1, que es un factor huésped involucrado en el daño del sistema nervioso causado por la infección por ZIKV [ 8 ]. Los autores sugieren que la inducción de ARNm de TNF-α puede inducir cambios en el fenotipo proinflamatorio, desempeñando un papel en la respuesta inmune [ 8 ].
Además, los EV de células C6 / 36 infectadas con ZIKV inducen altos niveles de factor tisular (TF) y la activación del receptor 1 activado por proteasa (PAR-1) en células HMEC-1 vírgenes [ 8 ]. El TF es un factor esencial en el mecanismo de coagulación de la sangre, ya que induce la producción de proteasas hemostáticas (trombina) para activar PAR-1, que participa en la expresión de moléculas pro-adherentes y proinflamatorias [ 8 ]. Por lo tanto, Martínez-Rojas et al. sugieren que los EV de las células infectadas con ZIKV contribuyen a la patogénesis durante la infección por ZIKV [ 8 ], ya que estos EV pueden infectar las células vasculares endoteliales con expresión de citocinas proinflamatorias para aumentar la permeabilidad vascular y el daño endotelial [ 8 ].
Por lo tanto, los exosomas / EV secretados por las células infectadas con flavivirus pueden estimular el endotelio y otras células inmunes para modular el entorno celular, promoviendo una respuesta inmune o contribuyendo a la patogénesis de la enfermedad por flavivirus.
Referencias
- Hurtado-Monzón, AM; Cordero-Rivera, CD; Farfan-Morales, CN; Osuna-Ramos, JF; De Jesús-González, LA; Reyes Ruiz, JM; del Ángel, RM El papel de la respuesta inmune humoral anti-flavivirus en la protección y la patogénesis. Rev. Med Virol. 2020 , e2100. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Muñoz-Jordán, JL; Fredericksen, BL Cómo los flavivirus activan y suprimen la respuesta al interferón. Virus 2010 , 2 , 676–691. [ Google Académico ] [ CrossRef ]
- Randall, RE; Goodbourn, S. Interferones y virus: una interacción entre inducción, señalización, respuestas antivirales y contramedidas de virus. J. Gen. Virol. 2008 , 89 , 1–47. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Takeuchi, O .; Akira, S. Inmunidad innata a la infección por virus. Immunol Rev. 2009 , 227 , 75–86. [ Google Académico ] [ CrossRef ]
- Best, SM Las múltiples caras de la proteína Flavivirus NS5 en el antagonismo de la señalización de interferón tipo I. J. Virol. 2017 , 91 , e01970-16. [ Google Académico ] [ CrossRef ]
- Mejor, SM; Morris, KL; Shannon, JG; Robertson, SJ; Mitzel, DN; Park, GS; Boer, E .; Wolfinbarger, JB; Bloom, ME Inhibición de la señalización JAK-STAT estimulada por interferón por un flavivirus transmitido por garrapatas e identificación de NS5 como un antagonista de interferón. J. Virol. 2005 , 79 , 12828–12839. [ Google Académico ] [ CrossRef ]
- Robertson, SJ; Mitzel, DN; Taylor, RT; Mejor, SM; Bloom, ME Flavivirus transmitidos por garrapatas: disección de respuestas inmunes del huésped y contramedidas de virus. Immunol Res. 2009 , 43 , 172-186. [ Google Académico ] [ CrossRef ]
- Latón, AL; Huang, I.-C .; Benita, Y .; John, SP; Krishnan, MN; Feeley, EM; Ryan, BJ; Weyer, JL; van der Weyden, L .; Fikrig, E .; et al. Las proteínas IFITM median la resistencia celular al virus de la gripe A H1N1, al virus del Nilo Occidental y al virus del dengue. Cell 2009 , 139 , 1243-1254. [ Google Académico ] [ CrossRef ]
- Chan, YK; Huang, I.-C .; Farzan, M. Las proteínas IFITM restringen la mejora dependiente de anticuerpos de la infección por el virus del dengue. PLoS ONE 2012 , 7 , e34508. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Jiang, D .; Weidner, JM; Qing, M .; Pan, X.-B .; Guo, H .; Xu, C .; Zhang, X .; Birk, A .; Chang, J .; Shi, P.-Y .; et al. Identificación de cinco proteínas celulares inducidas por interferón que inhiben las infecciones por el virus del Nilo Occidental y el virus del dengue. J. Virol. 2010 , 84 , 8332–8341. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Steinman, RM; Cohn, ZA Identificación de un nuevo tipo de célula en órganos linfoides periféricos de ratones. I. Morfología, cuantificación, distribución de tejidos. J. Exp. Medicina. 1973 , 137 , 1142-1162. [ Google Académico ] [ CrossRef ]
- Ho, LJ; Wang, JJ; Shaio, MF; Kao, CL; Chang, DM; Han, SW; Lai, JH La infección de las células dendríticas humanas por el virus del dengue provoca la maduración celular y la producción de citocinas. J. Immunol. 2001 , 166 , 1499–1506. [ Google Académico ] [ CrossRef ]
- Mishra, R .; Lata, S .; Ali, A .; Banerjea, AC Dengue fiebre hemorrágica: un trabajo realizado a través de exosomas? Emerg. Los microbios infectan. 2019 , 8 , 1626–1635. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Holley, CL; Topkara, VK Una introducción a los pequeños ARN no codificantes: miRNA y snoRNA. Cardiovasc. Drogas Ther. 2011 , 25 , 151-159. [ Google Académico ] [ CrossRef ]
- Zhang, Y .; Zhang, Q .; Gui, L .; Cai, Y .; Deng, X .; Li, C .; Guo, Q .; El, X .; Huang, J. Let-7e inhibe la expresión de TNF-α dirigiéndose a la metil transferasa EZH2 en células THP-1 infectadas con DENV2. J. Cell. Physiol 2018 , 233 , 8605–8616. [ Google Académico ] [ CrossRef ]
- Bott, A .; Erdem, N .; Lerrer, S .; Hotz-Wagenblatt, A .; Breunig, C .; Abnaof, K .; Wörner, A .; Wilhelm, H .; Münstermann, E .; Ben-Baruch, A .; et al. miRNA-1246 induce respuestas proinflamatorias en las células madre / estromales mesenquimales mediante la regulación de PKA y PP2A. Oncotarget 2017 , 8 , 43897–43914. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Pham, AM; Langlois, RA; Sin embargo, la replicación de BR en células de origen hematopoyético es necesaria para la diseminación del virus del dengue. PLoS Pathog. 2012 , 8 , e1002465. [ Google Académico ] [ CrossRef ]
- Bavia, L .; Mosimann, ALP; Aoki, MN; Duarte dos Santos, CN Una mirada a los ARN y microARN de flavivirus subgenómicos en las infecciones por flavivirus. Virol J. 2016 , 13 , 84. [ Google Scholar ] [ CrossRef ]
- Tambyah, PA; Ching, CS; Sepramaniam, S .; Ali, JM; Armugam, A .; Jeyaseelan, K. expresión de microARN en sangre de pacientes con dengue. Ana. Clin. Biochem. 2016 , 53 , 466–476. [ Google Académico ] [ CrossRef ]
- Silveira, GF; Meyer, F .; Delfraro, A .; Mosimann, ALP; Coluchi, N .; Vasquez, C .; Probst, CM; Báfica, A .; Bordignon, J .; Dos Santos, CND Dengue virus tipo 3 aislado de un caso fatal con complicaciones viscerales induce respuestas proinflamatorias mejoradas y apoptosis de células dendríticas humanas. J. Virol. 2011 , 85 , 5374-5383. [ Google Académico ] [ CrossRef ] [ PubMed ]
- McCandless, EE; Zhang, B .; Diamante, MS; Klein, el antagonismo de RS CXCR4 aumenta el tráfico de células T en el sistema nervioso central y mejora la supervivencia de la encefalitis por el virus del Nilo Occidental. Proc. Natl. Acad. Sci. Estados Unidos 2008 , 105 , 11270–11275. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Arjona, A .; Foellmer, HG; Ciudad, T .; Leng, L .; McDonald, C .; Wang, T .; Wong, SJ; Montgomery, RR; Fikrig, E .; Bucala, R. La abrogación del factor inhibidor de la migración de macrófagos disminuye la letalidad del virus del Nilo Occidental al limitar la neuroinvasión viral. J. Clin. Investigador 2007 , 117 , 3059–3066. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Punyadee, N .; Mairiang, D .; Thiemmeca, S .; Komoltri, C .; Pan-Ngum, W .; Chomanee, N .; Charngkaew, K .; Tangthawornchaikul, N .; Limpitikul, W .; Vasanawathana, S .; et al. Las micropartículas proporcionan un nuevo biomarcador para predecir los resultados clínicos graves de la infección por el virus del dengue. J. Virol. 2015 , 89 , 1587–1607. [ Google Académico ] [ CrossRef ]
- Hottz, ED; Medeiros-de-Moraes, IM; Vieira-de-Abreu, A .; de Assis, EF; Vals-de-Souza, R .; Castro-Faria-Neto, HC; Weyrich, AS; Zimmerman, GA; Bozza, FA; Bozza, PT La activación plaquetaria y la apoptosis modulan las respuestas inflamatorias de monocitos en el dengue. J. Immunol. 2014 , 193 , 1864-1872. [ Google Académico ] [ CrossRef ]
- Wu, M.-F .; Chen, S.-T .; Yang, A.-H .; Lin, W.-W .; Lin, Y.-L .; Chen, N.-J .; Tsai, I.-S .; Pequeño.; Hsieh, S.-L. CLEC5A es crítico para la activación del inflamasoma inducido por el virus del dengue en macrófagos humanos. Blood 2013 , 121 , 95-106. [ Google Académico ] [ CrossRef ]
- Wu, M.-F .; Chen, S.-T .; Hsieh, S.-L. Regulación distinta de la activación del inflamasoma inducido por el virus del dengue en subconjuntos de macrófagos humanos. J. Biomed. Sci. 2013 , 20 , 36. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gholipour, N .; Ohradanova-Repic, A .; Ahangari, G. Un nuevo informe de MiR-4301 induce la apoptosis celular al regular negativamente la expresión de DRD2 en células de cáncer de mama humano. J. Cell. Biochem. 2018 , 119 , 6408–6417. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Komina, A .; Palkina, N .; Aksenenko, M .; Tsyrenzhapova, S .; Ruksha, T. Efectos antiproliferativos y proapoptóticos de la inhibición de MiR-4286 en células de melanoma. PLoS ONE 2016 , 11 , e0168229. [ Google Académico ] [ CrossRef ]
- Venkatadri, R .; Muni, T .; Iyer, AKV; Yakisich, JS; Azad, N. Papel de los miARN relacionados con la apoptosis en la muerte celular por cáncer de mama inducida por resveratrol. Cell Death Dis 2016 , 7 , e2104. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Huang, Z .; Xu, H. MicroRNA-181a-5p regula la respuesta inflamatoria de los macrófagos en la sepsis. Open Med. (Guerras). 2019 , 14 , 899–908. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Su, Y .; Yuan, J .; Zhang, F .; Lei, Q .; Zhang, T .; Li, K .; Guo, J .; Hong, Y .; Insecto.; Lv, X .; et al. MicroRNA-181a-5p y microRNA-181a-3p restringen de forma cooperativa la inflamación vascular y la aterosclerosis. Cell Death Dis. 2019 , 10 , 1–15. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Zhu, J .; Wang, F.-L .; Wang, H.-B .; Dong, N .; Zhu, X.-M .; Wu, Y .; Wang, Y.-T .; Yao, Y.-M. El ARNm de TNF-α está regulado negativamente por microARN-181a-5p en la maduración de las células dendríticas inducidas por la proteína de la caja-1 del grupo de alta movilidad. Sci. Rep. De 2017 , 7 , 1–11. [ Google Académico ] [ CrossRef ] [ PubMed ]
This entry is adapted from the peer-reviewed paper 10.3390/v12070765