Фармакогеномика - это исследование того, как геномный фон связан с лекарственной устойчивостью и как стратегия терапии может быть изменена для определенного человека для достижения пользы. Тестирование фармакогеномики (PGx) дает врачам прекрасную возможность принять правильное решение в отношении каждого нетривиального пациента, который не отвечает на терапию. Хотя фармакогеномика стала проявлять растущий интерес для рынка здравоохранения в течение последних пяти-десяти лет, точные механизмы, связывающие генетический полиморфизм и наблюдаемые реакции на лекарственную терапию, не всегда ясны. Следовательно, успех тестирования PGx зависит от способности врача стандартизировать полученные результаты для каждого конкретного пациента.
- pharmacogenetics,pharmacogenetic test,personalized medicine,genetic polymorphism
1. Введение
P4-медицина представляет собой активно развивающееся направление современной медицинской науки. Концепция P4 основана на индивидуальном подходе к здоровью человека (персонализация, прогнозирование, предотвращение и участие). Современные диагностические наборы позволяют идентифицировать метаболические характеристики человека на молекулярном уровне, что позволяет выявить личную, генетически детерминированную предрасположенность к заболеванию или определенным метаболическим нарушениям у конкретных людей [ 1 ]. Персонализированная медицина включает медикаментозную терапию для улучшения состояния пациента и сведения к минимуму любых побочных эффектов, тем самым повышая качество жизни как на индивидуальном, так и на социально-экономическом уровнях.
Фармакогенетика восходит к 1959 году, когда Фогель ввел этот термин для обозначения тяжелых побочных реакций на лекарства у небольшого числа пациентов, о которых сообщили фармакологи [ 2 ]. Побочными реакциями, которые возникли после приема примахина, сукцинилхолина и изониазида, были анемия, апноэ и периферическая невропатия соответственно [ 3 , 4 ].
Фармакогенетика предназначена для изучения ответа на лекарственную терапию в зависимости от генетического фона. Ответ на лекарства часто регулируется генами, кодирующими белки, метаболизирующие лекарства, таким образом, регулируя трансформацию лекарства, фармакокинетику и фармакодинамику [ 5 ].
PGx может способствовать исследованию эффекта витаминов [ 6 , 7 ] и добавок / добавок и, в некоторой степени [ 8 ], гомеопатических препаратов. Однако нет убедительных доказательств взаимодействия между генами и витаминами / добавками / гомеопатиями.
Большинство связанных анализов PGx ошибочны или неверно истолкованы из-за предвзятости в дизайне эксперимента, небольшого размера выборки, небольшого размера популяции и недостаточного времени наблюдения. Пока что необходимы более точные эксперименты и исследования для наблюдения предполагаемых эффектов, в противном случае большинство дискуссий о возможном влиянии нефармакологических соединений на геном можно было бы считать сомнительными.
В клинической практике врач следует национальным стандартам специализированной медицинской помощи, основанным на данных фундаментальных исследований и клинических испытаний лекарств. Однако в большей степени терапевтический процесс остается творческой задачей [ 9 ].
Помимо побочных реакций на лекарства, организм может демонстрировать иммунитет и / или частичную реакцию на лечение [ 10 ]. Несмотря на то, что основные причины лекарственной устойчивости остаются неясными; однако можно предположить, что это связано с генетическими факторами. Кроме того, помимо предрасположенности к заболеваниям, различные метаболические функции организма также определяются генетически. А именно, генетические вариации, вероятно, определяют скорость синтеза и распада множества биомолекул в организме, действие фармацевтических препаратов, метаболизм питательных веществ и т. Д. [ 11 ]. Однако ответов на эти вопросы пока не получено.
Тем не менее, генетическое тестирование постепенно находит свою нишу при выборе лекарственной терапии - за этим процессом следует улучшение ухода за все более широким кругом пациентов. Фармакогеномные биомаркеры в маркировке лекарственных средств Управление по контролю за продуктами и лекарствами (FDA) предоставляет данные о 297 лекарствах для 100 молекулярных биомаркеров ( www.fda.gov/drugs/science-and-research-drugs/table-pharmacogenomic-biomarkers-drug-labeling ). Несколько компаний предлагают генетические тесты на побочные эффекты у пациентов.
2. Перспективы внедрения фармакогенетического теста в клинику.
В наши дни персонализированная медицина становится все более важной [ 18 ]. Продолжающиеся клинические испытания могут привести к внедрению фармакогенетических тестов в практику. Это может ускорить одобрение отдельных лекарств без обязательного тестирования на PGx, что сделает их выход на рынок более быстрым и экономичным. Обычно геномная информация, относящаяся к отдельным пациентам, предоставляется тем, кто назначает терапию. К 2017 году Великобритания планировала выполнить секвенирование 100000 геномов онкологических больных и пациентов, страдающих случайными или наиболее опасными инфекционными заболеваниями (ВИЧ, гепатит C, туберкулез), и предоставить фармакогенетическую информацию о пациентах, допущенных к исследованию. Национальная служба здравоохранения [ 19 ]. Компания 23andMe (Саннивейл, Калифорния, США) ( www.23andme.com ) также предоставляет фармакогенетическую информацию для руководства лечением непосредственно по запросу клиента [ 20 ]. FDA одобрило первый фармакогенетический тест в 2005 году. Это была тест-система AmpliChip CYP450, производимая Affymetrix (Санта-Клара, Калифорния, США) и Third Wave Technologies (Мэдисон, Висконсин, США). Молекулярный анализ Invader UGT1A1 (UDP-глюкуронозилтрансфераза). Процедура утверждения была одобрена клиницистами, общими системами здравоохранения, страховыми компаниями и заинтересованными пациентами, чтобы определить лучший способ интеграции этих тестов в клиническую практику [ 21 ]. В то же время были подняты критические вопросы о том, к кому следует применять тесты и каковы наиболее подходящие обстоятельства для их применения, какие доказательства требуются для применения этих тестов и как должны храниться результаты тестов. в электронных хранилищах медицинских данных [ 22 ]? Haga и Kantor [ 23 ] провели обзор лабораторий, предлагающих клиническое тестирование PGx в Соединенных Штатах. Из 111 проверенных лабораторий 76 предлагали услуги тестирования PGx. Из этих лабораторий 31 лаборатория предлагала тесты только на определенные гены; 30 лабораторий предлагали тесты на множественные гены, и только 15 лабораторий предлагали оба типа тестов. В общей сложности 45 лабораторий предложили 114 мультигенных панельных тестов, охватывающих 295 генов. Однако для большинства этих тестов не было клинических руководств [ 23 ]. В отрасли существует тенденция к использованию мультиплексных тестов, предназначенных для обнаружения полиморфизмов в большом количестве генов. В 2005 году одобренный FDA тест AmpliChip (Roche, Базель, Швейцария) был разработан для анализа двух генов [ 24 ]. В 2010 году Affymetrix представила чип DMET для диагностики 225 генов; последнее число теперь расширено до 231 гена [ 23 , 25 ]. В 2012 году исследователи из Стэнфордского университета и Университета Флориды разработали панель, содержащую массив SNP из 120 генов, включая 25 генов, ответственных за метаболизм лекарств, и 12 генов-носителей лекарств [ 26 ]. В 2014 г. был разработан тест захвата PGRN-Seq для анализа 84 фармакогенов [ 27 ]. Разнообразие генных панелей не ограничивается приведенными выше примерами. Доступны или разрабатываются другие виды фармакологических тестов [ 28 , 29 ].
В настоящее время клиническая значимость мультигенных панелей в основном зависит от нескольких хорошо изученных и классических генов. Используя панель захвата 84 генов PGRN-Seq, исследование только пяти генов из ок. 5000 пациентов указали, что 99% протестированных пациентов имеют по крайней мере один клинически валидный вариант или один известный вариант, имеющий значение для принятия решения о лечении [ 30 ]. Однако клиническое значение больших мультиплексных панелей во многом определяется определенной задачей, которую необходимо решить. Например, тестирование PGx может быть организовано как немедленное решение о лечении, основанное на группе генов с высоким уровнем доказательности для конкретного препарата. Однако наиболее распространенный тип мультигенного комплексного панельного PGx-теста без конкретных клинических показаний может быть выполнен для перспективного пациента. Такие тесты могут быть оправданы, поскольку в дальнейшем могут использоваться альтернативные препараты, а клиническая значимость данных может возрасти со временем. Несмотря на отсутствие консенсуса в отношении профилактического тестирования PGx [ 31 , 32 ], многие медицинские организации внедрили такие программы тестирования, чтобы получить ценную информацию о клинической валидности и полезности [ 27 , 33 ].
3.1. Аудитория для тестирования PGx
В настоящее время тесты PGx существуют в различных областях медицины, включая, помимо прочего, психиатрию, кардиологию, анестезию и онкологию. Некоторые клинические руководства по тестам PGx доступны для прогнозирования эффективности трициклических антидепрессантов (ТЦА) и селективных ингибиторов обратного захвата серотонина (СИОЗС) на основе активности CYP2D6 и CYP2C19 [ 34 , 35 ]. Недавние исследования показали уменьшение побочных эффектов и улучшение показателей у пациентов с депрессией после терапии антидепрессантами на основе PGx [ 36 ]. Тестирование PGx особенно привлекательно с учетом необходимых временных рамок. Например, для оценки полного терапевтического ответа на СИОЗС может потребоваться от 4 до 6 недель [ 37 ]. Пациент и врач могут потратить несколько месяцев на корректировку дозы и / или назначение новых лекарств, прежде чем станет ясно, что терапия не приводит к терапевтическому эффекту. Тестирование PGx может позволить врачу определить лучший препарат для данной ситуации в гораздо более короткие сроки.
Применимость тестирования PGx в определенной степени зависит от интенсивности потенциальных побочных реакций на препарат. Например, абакавир, используемый для лечения ВИЧ, может вызывать серьезные кожные побочные реакции (SCAR) [ 38 ]. В целом риск невелик, но вариация HLA-B * 57: 01 связана с гораздо более выраженным SCAR после приема абакавира. Таким образом, этот препарат противопоказан HLA-B * 57: 01-положительным пациентам [ 38 ].
Использование теста PGx имеет отношение к выбору дозы варфарина. Было обнаружено, что потребление витамина К с пищей, состояние здоровья и социальные условия, а также генетические вариации также влияют на терапию варфарином [ 39 ]. Изменения в CYP2C9 могут нарушить метаболизм варфарина, а изменения в VKORC1 (эпоксидредуктаза витамина К) могут увеличить лекарственную восприимчивость пациента [ 38 , 39 ].
Использование кодеина было ограничено взрослыми пациентами после доказательства риска усиления побочных эффектов у педиатрических пациентов. В ходе исследования были выявлены побочные реакции у младенцев, кормящие матери которых получали терапию кодеином [ 40 ]. Эти реакции являются результатом превращения кодеина в морфин, осуществляемого в основном белком CYP2D6 [ 41 ]. Подобные реакции могут возникать с другими обезболивающими, опосредованными CYP2D6, такими как трамадол, оксикодон и гидрокодон [ 42 ].
Выявлен высокий интерес пациентов к тестированию PGx [ 43 , 44 ]. Пациентов особенно интересует возможность использования рекомендаций, основанных на результатах теста PGx, для уменьшения побочных эффектов лекарств и выбора правильной терапии [ 45 ]. Однако стоимость тестов, страховое покрытие и доступность результатов тестирования представляют собой ограничения для тестирования PGx [ 46 , 47 ]. Некоторые вопросы все еще остаются неопределенными после тестирования PGx. Таким образом, пациенты должны быть соответствующим образом проинформированы о возможностях тестирования PGx [ 48 ].
По этой причине следует понимать, что тестирование PGx позволяет идентифицировать (1) препараты с повышенным риском возникновения побочных эффектов, (2) препараты с узким терапевтическим индексом. Кроме того, PGx-тестирование позволяет сократить набор препаратов для терапии и спрогнозировать дозировку препаратов [ 48 , 49 ]. В то же время тестирование PGx не будет эффективным для прогнозирования: (1) возникновения всех возможных побочных реакций с лекарством, (2) риска специфического побочного эффекта для всех лекарств, 3) риска возникновения осложнений [ 49 ].
Тестирование PGx дает возможность принять решение о том, являются ли выбранные лекарства и стратегия лечения преимуществами и дает надлежащие результаты по сравнению с ожиданиями, основанными на полученном профиле пациентов. Это именно то, что открывает двери для персонализированной медицины, это то, что должно произойти, когда у человека есть выбор: выздороветь, но не за счет ухудшения здоровья, не в ожидании, пока неподходящий препарат вызовет ужасные последствия вместо удовлетворительного результата.
2.2. Ресурсы в фармакогенетическом секторе
Из-за постоянно меняющейся природы генетической медицины следует знать о дальнейших изменениях в рекомендациях по тестированию или интерпретации результатов. Эту задачу можно упростить, если использовать доступные на данный момент ресурсы Интернета ( таблица 1 ).
Таблица 1. Наиболее посещаемые и популярные интернет-ресурсы в фармакогенетическом секторе.
| Ресурс | Описание | Справка |
|---|---|---|
| Coursera | Интернет-курс персонализированной медицины, который включает короткие обучающие курсы по генетике и механизмам, определяющим вариабельность реакции на лекарства; разработка этических вопросов и возражений, связанных с внедрением и внедрением широкомасштабного секвенирования генома в клиническую практику. | https://www.coursera.org/learn/personalizedmed |
| CPIC | Международный консорциум, который специализируется на публикации руководств по лекарственным препаратам на основе генотипов, чтобы помочь клиницистам понять применимость доступных результатов генетических тестов для оптимизации лекарственной терапии. | https://www.cpicpgx.org [ 50 , 51 ] |
| eMERGE | Финансируется NIH. Эта сеть объединяет исследователей с широким спектром знаний в области геномики, статистики, этики, информатики и клинической медицины от ведущих медицинских исследовательских институтов по всей стране до исследований в области геномики, включая открытия, клиническое внедрение и общедоступные ресурсы. | https://www.emerge-network.org |
| GTR | Бесплатный ресурс, который предоставляет обобщенное хранилище исчерпывающей информации о генетических тестах, которое предоставляется и поддерживается поставщиками; Основная аудитория - клиницисты и исследователи. | https://www.ncbi.nlm.nih.gov/gtr [ 52 ] |
| ЗАЖИГАТЬ | Был разработан для расширения использования геномной медицины путем поддержки включения геномной информации в клиническую практику и изучения методов эффективного внедрения, распространения и устойчивости в различных клинических условиях. | https://www.gmkb.org |
| Мой геном наркотиков | Портал для изучения того, как генетика влияет на реакцию на лекарства и как результаты генетического тестирования могут быть применены в здравоохранении. | https://www.mydruggenome.org |
| ФармГКБ | Онлайновая база знаний, отвечающая за сбор, подбор, интеграцию и распространение данных о влиянии генетической изменчивости на реакцию человека на лекарства. | https://www.pharmgkb.org [ 53 ] |
CPIC - Консорциум по внедрению клинической фармакогенетики; eMERGE - Сеть электронных медицинских записей и геномики; GTR - Реестр генетического тестирования; IGNITE - ГЕНОМИКА НА ПРАКТИКЕ; NIH - Национальные институты здоровья; PharmGKB - База фармакогенетических знаний.
Кроме того, известно меньше ресурсов, заслуживающих внимания. Среди них портал Mayo Clinic, на котором были опубликованы многочисленные образовательные материалы «AskMayoExpert» как для врачей, так и для пациентов с целью повышения общих знаний и практических навыков [ 54 ]. Детская исследовательская больница Сент-Джуда позволяет отслеживать интегрированную на веб-сайте информацию о генах или лекарствах, а также публикации и презентации по конкретным реализациям [ 55 ]. Компания Ubiquitous Pharmacogenomics (U-PGx) разработала платформу электронного обучения для распространения общих знаний по фармакологии, подходящую для врачей и фармацевтов ( https://upgx.eu/ ) [ 56 ].
Поддержка и развитие этих ресурсов может быть ценным инструментом для изучения предстоящих или менее известных фармакогенетических взаимодействий. Несколько организаций в настоящее время обеспечивают интеграцию с программами PGx и обновляют текущие данные [ 51 , 57 ].
2.3. Выбор тестирования PGx
PGx-тестирование может проводиться либо как анализ одного гена, либо как мультиплексная панель из десяти или более генов. Раннее тестирование в основном включает в себя анализ нескольких вариантов одного и того же гена с нацеливанием на наиболее распространенные и наиболее эффективные варианты. Новые технологии значительно увеличили количество генов и вариаций, охватываемых одним тестом. Большинство тестов PGx анализируют множество клинически значимых SNP. При определении лучшего теста или панели для пациента (или популяции) следует учитывать терапевтические показания. Например, для антидепрессивной терапии требуется тестирование на CYP2D6 и CYP2C19. Кроме того, также будет полезно подумать о том, выиграет ли пациент от теста PGx на сердечно-сосудистые и обезболивающие [ 58 ]. Панельный тест может быть более дорогостоящим, чем анализ одного гена, но он гарантирует, что лекарства, назначенные совместно, также будут проверены.
Панельные тесты PGx неоднородны и различаются по объему и объему [ 59 , 60 ]. Большинство панелей охватывает несколько наиболее изученных и наиболее эффективных генов. Панель может содержать комбинации SNP на основе обзора литературы о проспективных исследованиях. Панель, включающая множество генов, не обязательно может представлять дополнительную ценность для пациента, поскольку не все варианты имеют одинаковую клиническую значимость. Некоторые варианты могут быть чрезвычайно редкими за пределами определенных популяций, но могут быть довольно распространены в определенной группе. Например, вариант HLA-B * 15: 02, связанный с повышенным риском SCAR у пациентов, прописанных карбамазепином, имеет частоту аллелей 0,04% у пациентов европейского происхождения и 6,88% у пациентов восточноазиатского происхождения [ 61 ]. Панель может быть более полезной для пациента, если она будет более точно анализировать варианты, соответствующие их этническому происхождению.
Следует иметь в виду доступные альтернативы или специальные анализы. Множественные копии гена CYP2D6 (например, дупликации) встречаются примерно у 1 из 8 пациентов, и это число может быть еще выше у чернокожих и азиатских пациентов [ 62 ]. Дублирование генов может вызывать повышенную ферментативную активность и иметь клиническое значение. Однако не все панели могут выявить наличие или степень дупликации генов.
Помимо содержания панели, следует учитывать такие факторы, как тип биоматериала (буккальный мазок, слюна или кровь и т. Д.), Поскольку способ отбора биоматериала может представлять проблему для пациента. Доступ к результатам и методы их получения также представляют собой факторы, которые следует учитывать. Некоторые панели не предоставляют ничего, кроме сырых генетических данных, в то время как другие полностью интегрированы в электронную медицинскую карту и позволяют использовать сложные системы поддержки клинических решений (CDS). Наконец, следует учитывать потенциальную стоимость тестирования PGx. Пациенты различаются способами и способами оплаты тестирования.
2.4. Интерпретация результатов теста PGx
При назначении тестирования PGx следует иметь в виду, что полученный результат представляет собой лишь часть общей картины состояния пациента. Поэтому для определения рисков и преимуществ терапии следует использовать и интерпретировать результаты теста PGx с учетом состояния всех систем пациента, сопутствующих лекарств и текущих патологических состояний. Когда с помощью теста PGx определяется «лучший» препарат, это не обязательно означает, что его следует использовать в терапии, поскольку у пациента в анамнезе могут быть серьезные побочные реакции на препарат. И наоборот, выявление повышенного риска терапевтической неудачи с помощью теста PGx не должно приводить к отмене препарата, если текущая терапия эффективна. В зависимости от рассматриваемого гена и белка могут использоваться различные структуры результатов [ 63 ]. Некоторые гены можно описать с точки зрения метаболической активности, некоторые - по их общей функции, а другие - только как присутствующие или отсутствующие. Некоторые результаты тестов PGx описывают общую функцию гена, такого как SLCO1B1 (член семейства переносчиков органических анионов 1B1), связанного с симвастатином; VKORC1 (субъединица 1 комплекса эпоксидредуктазы витамина К), связанный с варфарином; OPRM1 (опиоидный рецептор Mu 1), связанный с опиоидами [ 63 ]. Результаты для этих генов могут быть представлены как нормальная, промежуточная или низкая функция. Например, результат «нормальная функция гена» указывает на то, что изменения режима дозирования пациента не требуется. В других случаях (снижение или плохая функция) рекомендации врача будут основываться на информации о сниженной функциональной активности (или полном бездействии) анализируемых генов.
Результаты теста PGx могут быть «положительными» или «отрицательными» [ 57 ]. Например, гены лейкоцитарного антигена человека (HLA) продуцируют важные компоненты иммунной системы. Пациенты с положительным результатом на HLA-B * 58: 01 имеют повышенный риск гиперчувствительности к аллопуринолу; Пациенты с положительным результатом на HLA-B * 15: 02 имеют повышенный риск SCAR при применении карбамазепина или окскарбазепина [ 64 , 65 ].
Способ представления результатов может значительно отличаться от одного отчета к другому. Результаты могут быть представлены либо в виде сырых генетических данных, либо в качестве окончательной терапевтической рекомендации. В отчетах для описания результатов может использоваться собственная иконография. В этой пиктограмме могут использоваться специальные символы для обозначения пациентов, у которых ожидается повышенный риск побочных эффектов или неэффективности терапии. В других отчетах можно использовать режим светофора с тремя основными категориями лекарств: зеленый для нормального риска, желтый для использования с осторожностью и красный для исключения. Результаты, отображаемые в любом формате, могут привести к тому, что поставщик чрезмерно упростит результаты теста PGx, игнорируя дополнительные клинические соображения.
Ниже ( рис. 3 ) приведен пример сокращенного теста PGx, выполненного AyassBioScience (Фриско, Техас, США). (полный отчет можно найти на https://ayassbioscience.com/wp-content/uploads/2020/02/PGX-Medical-ManagementPrint-Fit-on-Page.pdf ).
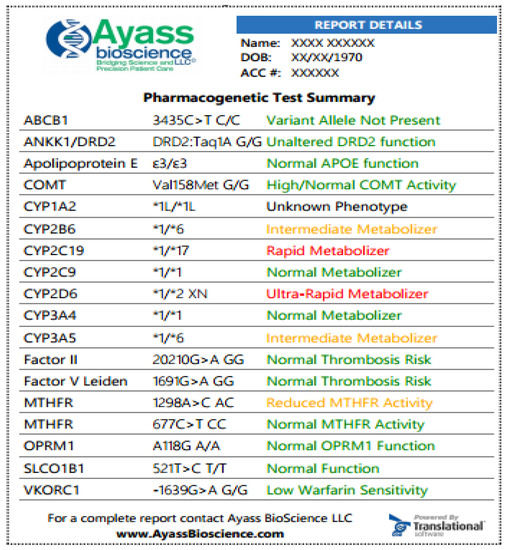
Рис. 3. Образцы теста PGx в AyassBioScience: отчет снабжен цветной информацией для облегчения навигации и внимания. Жадный цвет говорит о том, что лекарство можно назначать по стандартным схемам, и риск указанного состояния не повышен; желтый цвет - указывает на то, что требуется корректировка дозировки, имеется повышенная бдительность или у пациента умеренный риск указанного состояния; красный цвет означает, что лекарство потенциально имеет пониженную эффективность и повышенную токсичность или что у пациента повышенный риск указанного состояния. В приведенных в качестве примеров результатах у пациента наблюдается нормальный ответ на апиксабан (препарат является субстратом для белков оттока P-gp (ABCB1) и BCRP (ABCG2) и, возможно, сниженный ответ на бупропион. Бупропион метаболизируется до его активного метаболит гидроксибупропиона с помощью CYP2B6. Этот метаболит способствует терапевтическому эффекту бупропиона при использовании в качестве средства для прекращения курения или в качестве антидепрессанта. У пациента также усиливается реакция на кодеин, который превращается в его активный метаболит морфин с помощью CYP2D6. Поскольку этот пациент является сверхбыстрого метаболизатора (УМ) ожидается значительно повышенный уровень морфина, и пациент подвергается высокому риску токсичности при приеме кодеина.
В отчете можно использовать различные способы представления информации. Поскольку каждый способ отличается, нужно быть осторожным, чтобы обеспечить полное понимание значения каждой категоризации [ 49 ].
2.5. Инструменты автоматизации для интеграции тестирования PGx в клинику
Быстро развивающиеся новые технологии секвенирования ДНК позволяют быстро и эффективно определять геномные характеристики организмов. Основным результатом развития геномных и постгеномных технологий стало значительное расширение возможностей изучения генетической природы всего спектра заболеваний человека. Полногеномное ассоциативное исследование (GWAS) клинических образцов позволило собрать данные о генетическом составе конкретных групп (семей или популяций), чтобы разработать индивидуальный подход к лечению. В связи с этим на сегодняшний день особую актуальность приобретают исследования механизмов генетической предрасположенности к многофакторным заболеваниям и выявление конкретных генетических маркеров. Такие методы широко используются в мире и в России, где современные технологии секвенирования постепенно внедряются в медицинские исследования и медицинскую практику, чтобы олицетворять стратегию лечения.
Секвенирование следующего поколения (NGS) используется для углубленного (множественного) считывания генетического материала, что необходимо, например, для повторного секвенирования и сборки новых геномов (de novo), транскриптомов и эпигеномных исследований. Этот метод позволяет выявить редкие вариации и лучше понять генетическую функцию. Однако лавина новых данных также создаст проблемы для исследователей и клиницистов, давая множество «вариантов неизвестной важности» при отсутствии четких показаний [ 49 ]. Модификации CDS необходимы для обеспечения хранения и использования новой архитектуры данных и новых программ доступности данных. Это, в свою очередь, откроет значительные возможности в ближайшие годы. Некоторые системы здравоохранения используют инструменты CDS для интеграции данных тестов PGx в процесс принятия клинических решений и предоставления информации конечным пользователям [ 66 ]. Системы CDS могут использоваться для введения лекарств высокого риска и предоставления автоматизированных рекомендаций, указывающих, почему определенные модификации должны быть применены к выбранному лекарству или дозе.
В исследовании U-PGx PREPARE были разработаны решения для сайтов с ограниченной инфраструктурой электронных медицинских карт. Карта «Safety-Code» является частью мобильного CDS, и с помощью кода быстрого ответа медицинский работник направляется на веб-сайт с рекомендациями по дозировке, адаптированными для пациента [ 67 ]. На этой карточке также представлен обзор наиболее важных результатов теста PGx со списком препаратов с существующими (известными) рекомендациями [ 68 ].
Такие инструменты CDS будут необходимы, поскольку тесты PGx станут более распространенными из-за появления новых результатов и форматов тестов. Можно также сосредоточиться на разработке ориентированных на пациента приложений и порталов, через которые пациент может взаимодействовать со своими поставщиками услуг и получать консультацию по результатам.
Повышение осведомленности медицинских работников и пациентов может стимулировать использование PGx-тестирования. Следовательно, лаборатории будут корректировать объем и тип доступных клинических тестов PGx в зависимости от клинических требований. Ожидаемый рост разработки мультигенных панельных тестов PGx следует за достижениями в онкологии, микробиологии и других областях. Однако надлежащее клиническое использование таких тестов, по-видимому, более сложное, требующее поддержки и участия множества заинтересованных сторон.
This entry is adapted from the peer-reviewed paper 10.3390/pharmaceutics12121240
