Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Biotechnology & Applied Microbiology
藏红花素是中药用植物番红花中最有价值的成分之一,广泛用于食品、化妆品和制药行业。然而,传统的藏红花种植无法满足全球市场对藏红花素日益增长的需求,因此研究人员已将注意力转向藏红花素在多种寄主中的异源生产。目前,有报道称,在大肠杆菌、酿酒酵母、微藻和不自然产生藏红花素的植物中成功异源生产藏红花素。
- synthetic biology
- crocin
- heterologous production
- microalgae
1. 引言
藏红花素作为一种高价值的类胡萝卜素,在药理学上具有巨大的潜力。如今,藏红花素合成途径中的许多关键酶已被转录组学和动态代谢组学研究广泛揭示,而传统的培养模式无法在短时间内解决藏红花素的产生问题。利用基因工程技术改造藏红花素合成途径的关键酶,在β-胡萝卜素产率高或具有合成β-胡萝卜素或藏红花素潜力的物种中产生藏红花素,可能是一个新的方向(图1)。根据现有报道,许多微生物已被成功转化合成藏红花素或藏红花素,包括大肠杆菌[7]、酵母[62]、青烟[108]、寻常小球藻[109]和杜氏盐藻[104]。最近,有报道称本氏猪笼草瞬时转化合成藏红花素[102]。以上案例为藏红花素的进一步异源生产提供了坚实的理论支持和实践依据。下面,这些病例分为高等植物宿主和微生物宿主,又分为大肠杆菌、酵母和微藻(图1)。
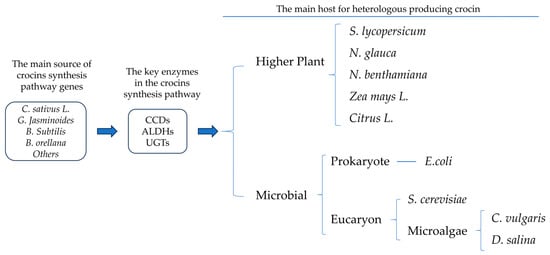
图 1.基因工程和共同宿主异源合成藏红花素的基本逻辑。
2. 藏红花素在高等植物寄主中的生物合成
在植物中,β-胡萝卜素可以转化为其他类胡萝卜素以满足特定需求,特别是在利用类胡萝卜素减少光氧化损伤的植物中[14,107]。藏红花素在植物中的异源生产的优点是只需要引入一个或两个基因,因为类胡萝卜素途径中的其他基因已经存在[98]。高等植物细胞具有丰富的β胡萝卜素储存能力、完整的类胡萝卜素合成系统和完整的内膜系统,是异源生产藏红花素的理想宿主细胞[107]。除苜蓿外,藏红花素还存在于鸢尾科以外的多种植物中,如大菖蒲的花和茉莉花的果实[5,12]。然而,这些来源无法满足现有需求[49]。因此,研究人员正在研究如何在其他高等植物中有效地生产藏红花素。
1986年,科学家首次在烟草细胞中表达人类生长激素,并提出了利用植物细胞作为重组蛋白生产平台的概念[88]。经过30多年的发展,植物宿主已经变得极其多样化,包括整株植物、各种植物组织、悬浮细胞等系统;此外,每个系统内有多种表达方法[110,111]。全株栽培需要特殊的土地和气候条件,不适合快速生产特定的代谢产物[112,113]。然而,与大肠杆菌和酿酒酵母类似,分离的单细胞植物愈伤组织可以悬浮并分散在液体培养基中,以实现产物的快速繁殖和表达[114]。因此,植物细胞悬浮培养比全株培养更具大规模工业化应用前景[115]和生产高附加值的天然活性产物[110,116]。
本氏猪笼草是一种本身不含藏红花素的植物,但当它用适当的 CCD 酶进行改造时,它可以利用藏红红花素合成途径过表达上游或下游类胡萝卜素代谢基因。Zheng等[98]以白色柑橘愈伤组织为宿主细胞,其共表达系统由Tp-CrtB、Os-BCH和Gj-CCD4a三个基因组成,成功构建了非绿色富含淀粉的组织/器官表达平台,有效生产藏红花素。当将平台引入本氏猪笼草的叶片中时,可获得高达1.6 mg/g干重的藏红花素。研究发现,Gj-CCD4a在叶片中具有较高的底物特异性和催化效率,表明单一酶Gj-CCD4a可以驱动藏红花素的合成[98]。Xie等[102]将融合策略与2A多肽连接相结合,成功构建了包含4个基因的多基因载体,将GjCCD4a和2个下游糖基转移酶基因Gj-UGT74F8和Gj-UGT94E13转化,实现了更高的底物转化效率,解决了主要活性成分藏红花素I和藏红花素II比例低的问题, 特别是藏红花素I,如先前在转基因烟草中合成藏红花素的研究所证明的那样,并首次将ALDH转化为烟草。
一个相关的物种,N. glauca,在其花瓣中含有类胡萝卜素色素。Huang等[108]在藏红花的花瓣和叶片中组成型表达Bd-CCD4.1酶,分别获得321.6 ± 21.3 μg/g和302.7 ± 25.6 μg/g DCW藏红花素。有趣的是,在表达CsCCD2L的转基因株系中,叶子和花瓣之间藏红花素积累的差异可能是由于玉米黄质的积累相对较高或CCD在叶片中的组织特异性[108]。Martí等人利用烟草蚀刻病毒驱动本氏猪笼草中Cs-CCD2L和Bd-CCD4.1的表达,发现在13天内,只有Cs-CCD2L可以产生2.18±0.23mg藏红花素和8.24±2.93mg苦霉素/克(DCW)。该研究还发现,CCD可以拦截叶片中的代谢通量,减少叶黄素的合成,从而急剧增加八氢番茄红素的表达水平,并带动类胡萝卜素代谢途径向藏红花素合成方向发展[52]。
Frusciante等人通过农杆菌介导的瞬时表达将CCD2引入富含玉米黄质的玉米胚乳中,发现与大肠杆菌只能检测到藏红花素二醛不同,玉米黄质不仅转化为藏红花素二醛,而且进一步氧化为藏红花素。这可能是因为玉米胚乳具有内源性醛脱氢酶,以促进氧化步骤。
由于液泡的存在,与大肠杆菌和酿酒酵母相比,植物细胞很大。因此,当使用可比的培养体积时,很难通过增加细胞数量来提高植物细胞培养物的产量。因此,重组蛋白产物在植物细胞系统中的产量相对较低(0.01-10mg/L)[110,111]。此外,由于存在外源植物酶,并非所有植物物种都能适应发酵罐中的悬浮细胞培养[117]。
3. 藏红花素的微生物生物合成
生产藏红花素的另一种方法是组合生物合成,它包括结合来自不同物种的酶编码基因,并设计一组新的基因簇以在异源宿主中产生生物活性化合物。生产藏红花素的常用微生物宿主是原核生物中的大肠杆菌和真核生物中的酿酒酵母[7,62]。选择合适的宿主生物对于优化产品产量和质量非常重要,在这种情况下,细菌和酵母各有利弊。细菌宿主生命周期短,易于基因操作和处理,具有较高的生长速率和极好的蛋白质和酶过表达潜力;然而,它们对大蛋白和需要翻译后修饰的蛋白质没有那么有益,而翻译后修饰对于正确的折叠和功能活性可能是必不可少的[115]。酿酒酵母也具有很好的特征,像大肠杆菌一样易于生长和操作,但除此之外,还可以通过适当的翻译后修饰表达蛋白质,并提供更好的膜蛋白表达;此外,它具有食品级状态(通常被认为是安全的;GRAS)[118]。然而,它导致的产量低于细菌,并且会在重组蛋白中添加大量甘露糖残基,导致蛋白质错误折叠和活性问题[117]。
总而言之,藏红花素在微生物中的异源生产是非常有利的,因为它们可以在廉价的基质上生长,并且与植物相比,它们更容易操作并且具有非常快的生产周期,使藏红花素的生产速度更快,可能生产量更大[119]。因此,考虑到所有的利弊,微生物异源生产藏红花素的商业应用是更具吸引力的途径。
3.1. 藏红花素在大肠杆菌中的生物合成
野生型大肠杆菌本身不具备合成类胡萝卜素的能力,但经过代谢工程后,可以成功合成β-胡萝卜素和其他各种类胡萝卜素[120,121,122]。因此,大肠杆菌在经过适当的途径修饰后具有合成藏红花素的潜力。
这是第一篇证明胡萝卜素基因簇在大肠杆菌中功能表达的报道:Perry等[123]和Tuveson等[124]将欧文氏菌(重新分类为Pantoea agglomerans)的12.4 kb胡萝卜素基因簇引入大肠杆菌中,并成功产生黄色色素沉着。Misawa等[125]从上述基因组片段中分离出一个6.9 kb的产生黄色素的基因簇片段,发现了6个开放阅读框:CrtE、CrtI、CrtB、CrtX、CrtY和CrtZ。证实利用该基因簇产生的黄色物质为玉米黄质,重组大肠杆菌还能以GGPP为底物合成八氢番茄红素、番茄红素、β-胡萝卜素、玉米黄质和碱性类胡萝卜素。近年来,大肠杆菌常被用作生产各种类胡萝卜素的宿主菌株,从而为原核生物中藏红花素的异源合成提供了理论依据。
在藏红花素合成方面,Wang等[7]将苜蓿的Cs-CCD2L基因和茉莉花的糖基转移酶Gj-UGT94E5和Gj-UGT75L6引入大肠杆菌中,从而产生玉米黄质和藏红花素二醛。该菌株在使用来自Neurospora crassa的pTrc-ALD8基因进行进一步工程后能够产生藏红花素。最后,将Bs-YjiC、Bs-YdhE和Bs-YojK的糖基转移酶引入表达体系,得到藏红花素V,收率为4.42 mg/L。这是首次在大肠杆菌中成功构建异源藏红花素和藏红花素合成途径[7]。Ding等[101]成功提取了两种微生物衍生的糖基转移酶,具有更高的异源产生和催化效率,提高了藏红花素的产生。结果表明,枯草芽孢杆菌168的Bs-GT糖基转移酶最高可达到81.9%的藏红花素糖基化转化效率,藏红花素V和藏红花素III的得率为476.8 mg/L。Bc-GTA的转换效率和特异性远低于Bs-GT[101]。Pu等[61]发现,G.-jasminoides衍生的Gj-UGT74F8和Gj-UGT94E13对50 mg/L藏红花素的全细胞生物转化率分别高达66.1%和59.6%,高于使用微生物UGTs实现的全细胞生物转化率。通过精确控制糖基化时间过程,可以获得具有特定糖基化程度的高浓度藏红花素。栀子花UGTs的进一步优化可能为藏红花素的工业化生产提供有价值的工具[126]。同时,Pu等人还发现,培养环境中的葡萄糖含量是获得藏红花素的关键因素之一。当工程菌株的内源性UDPG供应不足以高效生产藏红花素时,适当补充一定浓度的葡萄糖可以提高异源表达UGTs的催化活性,以维持高效和可持续的生产[61]。
大肠杆菌中藏红花素的合成已得到充分研究。然而,与其他原核生物一样,大肠杆菌没有像真核生物那样复杂的内部膜系统。因此,大肠杆菌中各种真核酶的异源产生可能导致折叠和官能团修饰的差异,进而可能导致催化效率降低或酶活性降低。由于苜蓿是一种真核生物,藏红花素的合成涉及代谢物在多个亚细胞区室之间的转移,例如从质体到液泡,以及各种相关酶的合作[8]。缺乏这些酶或使用结构有缺陷的酶可能会影响藏红花素的产生或产生有毒的副产物。Zheng等[98]将β-载脂蛋白-8′-胡萝卜素作为底物,与表达Gj-CCD4a的大肠杆菌细胞粗裂解物一起孵育,在体外获得藏红花素二醛,表明大肠杆菌中表达的Gj-CCD4a具有酶活性。然而,虽然大肠杆菌本身没有内源性原子酒精性沉积,但据报道,在大肠杆菌中表达的微生物来源的原子层沉积的性质优于内源性苜蓿酒精性脂肪酸,而其他植物来源的原子酒精性沉积在大肠杆菌中的表达水平非常低[7]。需要对候选原子层沉积进行进一步研究和优化。
3.2. 酿酒酵母藏红花素的生物合成
由于其GRAS地位,酿酒酵母经常用于食品加工领域。与大肠杆菌的细菌模型不同,酿酒酵母是一种真核微生物,因此具有一套完整的细胞内膜,包括核膜和各种细胞器膜,与植物和哺乳动物细胞中的细胞膜相似,为外源基因提供了完整的转录、翻译和修饰环境[127].细胞内部的各个隔室还可以为基因表达产物和代谢物提供运输和储存空间。由于酿酒酵母没有合成类胡萝卜素的内源性生化途径,因此有必要重新设计启动MVA途径的藏红花素合成酶,以将底物水平提高到下游途径所需的水平[105,128]。Shimada等人通过引入番茄红素合成所需的三个基因,即CrtE、CrtB和CrtI,重新定向了酿酒酵母的麦角甾醇生物合成途径,从而能够以1.1 mg/g的干细胞重量(DCW)的产率合成番茄红素。麦角甾醇是一种异戊二烯,与β-胡萝卜素共享前体,可为藏红花素的生产提供丰富的底物[129]。Lv等[130]在酿酒酵母中设计了一种双重代谢途径,同时在细胞质和线粒体中使用乙酰辅酶A。在提高前体利用率和扩大异戊二烯生产方面,表明这种双代谢途径比重组菌株中仅使用线粒体途径或细胞质途径具有优势。
Mei等[131]最初发现,当将Eu-CrtZ引入酿酒酵母中,同时敲除负责将法呢基焦磷酸盐引向麦角甾醇合成的基因Lpp1和Dpp1时,最初发现玉米黄质的产量仅少量增加,但当使用三个拷贝的GAL1高强度启动子时,玉米黄质的产量高达96.2 mg/L。通过Eu-crtZ的多拷贝整合提高玉米黄质的产生[89]。通过将Eu-crtZ基因整合到26S rDNA区域,提高了溶脂耶氏菌玉米黄质的产生,其中该基因导致产生靶分子(表达盒)的最高滴度和含量。Xie等[89]玉米黄质滴度比单拷贝增加4.02倍,玉米黄质含量增加721%,玉米黄质滴度为21.98±1.80 mg/L。这种高产工程菌株被命名为SyBE-Sc0123Z020。 Chai等[62]从不同物种中选取了3种关键酶,即CrtZ、CCD和ALD,用于酿酒酵母菌株SyBE-SC0014CY06中表达,该菌株能够产生β-胡萝卜素。3个基因的最佳组合分别是来自Pantoea stewartii的Ps-CrtZ、来自C. sativus的Cs-CCD2L和来自集胞藻属的Syn-ALD。PCC6803,两者合计产生0.633 mg/L藏红花素。Tan等[66]设计、优化合成了一种新的Cs-ALD酶,并将其引入酿酒酵母SyBE-Sc02070187-189中,该酶能够产生玉米黄质,得到62.79 μg/g DCW藏红花素二醛的收率。Song等[105]敲除了CIT2和MLS1这两个在细胞质中消耗乙酰辅酶A的基因,使番茄红素的产生增加了50%。然后,他们构建了一种由Ps-CrtZ和CsCCD2组成的融合酶,使藏红花素的浓度提高了44%,产生了12.43±0.62 mg/L藏红花素,是初始菌株SyBE-Sc0123C050产生的浓度的两倍[62]。上述例子表明,酿酒酵母藏红红花素的产生是可行的,这可以为真核生物藏红花素的生产提供一条安全有效的途径。
然而,酿酒酵母含有五个表征的内源性ALDH基因和大量其他内源性ALDH基因,这些基因尚未完全表征且难以去除。这些内源性ALDH基因会严重干扰外源性ALDH基因的表达和功能,显著降低藏红花素的生产力[63]。扩增酿酒酵母外源ALDH基因的拷贝数可以竞争性抑制内源ALDH基因的表达和功能,提高外源ALDH基因的表达和特异性,从而增加藏红花素的产生[63]。Chai等[63]使用多拷贝质粒pRS426增加Cs-CCD2L和Syn-ALD的拷贝数后,藏红花素的产量进一步提高到1.219 mg/L,是单拷贝质粒产量的2倍。
3.3. 微藻宿主中藏红花素的生物合成
微藻是生活在水生环境中的微观光合真核生物[132]。微藻作为起源于约1亿年前的单细胞生物和陆地植物的祖先,其类胡萝卜素合成途径与高等植物相似[85,133]。因此,微藻中存在CCD1、CCD7、CCD8和NCED的同源物,因此可以从β-胡萝卜素异源合成藏红花素[85,134]。事实上,微藻中复杂的类胡萝卜素代谢系统可以合成多种存在于陆地植物中的类胡萝卜素,如叶黄素、虾青素、岩藻黄质和β-胡萝卜素[135]。基于衣藻β-胡萝卜素合成途径的背景,可以大大减少藏红花素合成途径模块的构建线和工作量。
微藻的特点是生长速度快,内源性代谢途径相对容易修饰,无声基因或低水平表达基因的补体;这简化了它们用作藏红花素生物反应器的代谢工程[136]。微藻中的类胡萝卜素已用于商业目的。例如,寻常梭菌可利用番茄红素作为前体,在不同培养条件下合成β-胡萝卜素、玉米黄质、虾青素等物质[136]。盐碱可以在极高盐的环境中生存,自然产生β胡萝卜素。高盐度培养环境的一个好处是可以有效抑制其他微生物的污染,从而降低培养成本[137]。
在1960年代,寻常梭菌因其结构简单、生长迅速、维护成本低而成为第一个被大规模开发的单细胞绿藻[138]。寻常梭菌已被用作细胞工厂,可以通过光合作用合成各种营养物质;它还能够合成蛋白质、碳水化合物、类胡萝卜素和脂质。其蛋白质含量可高达68%,广泛用于人类保健食品和添加剂以及水产养殖中的动物饲料[139,140,141,142]。然而,不平衡的细胞代谢通量以及中间体和前体代谢物之间的竞争是微藻中藏红花素异源表达的挑战。番茄红素ε-环化酶(LCYE)是一种将番茄红素环化为α-胡萝卜素的关键酶,为叶黄素的合成提供了大量的底物[143]。LCYE的酶由CvLCYE基因编码,其核苷酸序列在多种绿藻中高度保守[109]。CvLCYE基因的过表达可以大大改善寻常梭菌叶黄素的产生[109]。通过阻断或沉默CvLCYE基因的表达,更多的番茄红素可以流向β-胡萝卜素合成,从而为藏红花素的合成提供更多的底物。
基于寻常梭菌的这一特性,Lou等[103]利用农杆菌介导的雨生红球藻CrtRB基因和寻常梭菌柱头的ZCD1基因瞬时表达,成功检测了藏红花素的积累。这是第一份证明微藻中藏红花素产生的报告。ZCD1是Cs-ZCD的13个氨基酸突变体,最初缺乏玉米黄质双加氧酶活性所需的残基和结构域;这种修饰恢复了活性[96,103],这对于修饰CCD的弱活性和增加藏红花素的产生具有重要意义。
盐藻是一种自由移动的单细胞绿色微藻,有鞭毛,但没有刚性细胞壁[144]。盐水楠的细胞内甘油含量超过其重量的50%,这使得它可以通过改变细胞内甘油浓度来调节渗透压[145]。因此,它可以在0.5%-35%的盐溶液中存活,即在接近饱和的溶液中存活[145]。它是已知最耐盐的真核生物之一[146]。盐碱的最佳生长盐浓度范围为1.0–2.0 M NaCl[147]。在高盐胁迫条件下,即3.0-4.0 M NaCl,叶绿素的合成和细胞生长受到抑制[148]。然而,当在最佳盐浓度下操作时,大多数非盐素耐受细菌或原生生物的污染最小,从而降低了生产成本并有助于维持无菌环境[149]。与高等植物相比,微藻生长迅速。大多数高等植物的生长和繁殖都依赖于光合作用[145,150]。另一方面,盐碱菜的β-胡萝卜素含量在植物界中含量最高[151,152]。它富含叶黄素、玉米黄质和β胡萝卜素,后者占DCW的14%[153]。盐碱是商业化生产β胡萝卜素应用最广泛的藻类之一,在藏红花素合成方面也具有很强的潜力[144,154,155,156]。由于微藻在适应各种生长条件和气候(例如,冰川到热带,淡水到高盐)和不同的pH值方面具有多功能性,因此与高等植物相比,微藻显示出明显的优势,减少了对复杂培养设备的需求,从而降低了成本。微藻通常比高级植物具有更高的类胡萝卜素含量。盐藻中的主要类胡萝卜素包括9-或9'-顺式β-胡萝卜素和全反式-β-胡萝卜素,与9-顺式-β-异构体相比,胡萝卜素优先被吸收[151]。然而,与反式键相比,由于顺式键的反应性更高,因此9-顺式β-异构体具有更高的抗氧化活性[151]。在迄今为止研究的所有天然来源中,盐水草的9-顺式β-胡萝卜素含量最高,DCW含量高达100g/kg[151,152]。这将为盐水苜蓿生产藏红花素提供一个大型底物池[157]。用促有丝分裂抑制剂(丙噼胺和氯丙虫胺)处理10 h后,盐碱中八氢番茄红素的相对类胡萝卜素含量(占总类胡萝卜素的百分比)增加了48倍以上[157]。番茄红素和β-胡萝卜素的产生在红光照射后也显著增加。这是由于在高强度红光条件下更容易降解的9-顺式β-胡萝卜素的积累;这种情况与高光氧化速率有关,这反过来又增加了β-胡萝卜素异构酶的活性,其基因转录本是由光胁迫诱导的[158]。盐水斩斩的这些特性为转基因技术合成藏红花素提供了一定的条件。
By mining the transcriptome and genome of D. salina using deep sequencing, Lou et al. [159] found that, under high-light and high-salinity stress, D. salina activates an endogenous miRNA, m0533-3p, which in response to the stress signals inhibits malate dehydrogenase. This is likely to lead to a reduced flow of acetyl-CoA into the tricarboxylic acid cycle and instead greater participation of acetyl-CoA in the synthesis of GGPP, with a concomitant increase in β-carotene levels. However, as salt concentration increases, D. salina is more inclined to divert β-carotene to α-ionone and β-ionone synthesis to improve stress resistance, resulting in a decrease in β-carotene reserves, thus affecting the conversion efficiency of crocin [160,161,162]. Therefore, to balance these two opposing fluxes, the optimal salt concentration for D. salina should be 1.5 M NaCl [160,161]. Hou [104] introduced CrtRB, Cs-ZCD, and CCD2 as target genes into D. salina by the glass-bead method and successfully detected trace amounts of crocetin dialdehyde.
D. salina has many applications in the pharmaceutical, nutraceutical, and cosmeceutical industries. However, although there are thorough and comprehensive research methods for using microalgae to produce other carotenoid products, they are still in the initial stages as hosts for the production of crocin; still, they have great potential for this application [42,163]. Nevertheless, it will not be enough to identify and modify the key enzymes in engineered pathways; there will also be a requirement for increased investment in the optimization of algal strains and for further investigation and optimization of culture conditions, methods of exogenous gene transformation, and the selection of transcription and translation-related factors [164].
This entry is adapted from the peer-reviewed paper 10.3390/md22010022
This entry is offline, you can click here to edit this entry!
