1. Wstęp
Nie ma zgody co do wyników niezbędnych do oceny funkcji kończyny górnej u pacjentów po udarze [
1 ]. W fazie ostrej i podostrej pacjenci w ciągu sześciu miesięcy od udaru mózgu poddawani są kompleksowej i specjalistycznej ocenie stanu zdrowia [
2 ]. Proces ten, odbywający się w klinikach szpitalnych, polega na określeniu celów rehabilitacji i leczenia, wyborze interwencji terapeutycznych i ocenie postępów [
3 ]. Skuteczna rehabilitacja pacjentów po udarze mózgu zależy od skutecznej oceny deficytów motorycznych, trafnych diagnoz i wyborów terapeutycznych, właściwej oceny wyników oraz długotrwałego leczenia i rehabilitacji w celu utrzymania powrotu do zdrowia w fazie przewlekłej [
4 ]. Istnieje wiele perspektyw, z których można badać ręczne pomiary wyników, co podkreśla złożoność oceny postępu rehabilitacji. Perspektywy te obejmują pomiary fizjologiczne skupiające się na zmianach i ulepszeniach fizycznych, wskaźniki jakości życia oceniające wpływ na codzienne życie i samopoczucie pacjentów, fazę rekonwalescencji po udarze w celu ustalenia odpowiednich interwencji dostosowanych do konkretnego etapu oraz rodzaj leczenia. opieki szpitalnej, jakiej potrzebuje pacjent, a która może się różnić w zależności od indywidualnych potrzeb i postępów. Zaburzenia motoryczne kończyny górnej po udarze mózgu przyczyniają się do osłabienia siły mięśni. Niska siła mięśni wiąże się ze zjawiskami zmęczenia, obniżoną wytrzymałością i nieefektywnym wykonywaniem zadań przez pacjenta [
5 ]. Są to główne problemy występujące w niedowładzie połowiczym [
6 ]. Obraz pacjenta z niedowładem połowiczym po udarze mózgu jest niejednorodny [
7 ]. Dynamometry statyczne i izokinetyczne służą do uzyskania obiektywnych wyników wytrzymałości mięśni, a także samej siły mięśni [
5 ]. Pacjenci w fazie przewlekłej z niedowładem otrzymują reedukację liczby jednostek motorycznych i długotrwałe odnerwienie mięśni niedowładnych, co przyczynia się do osłabienia mięśni [
8 ]. Zręczność manualna może być cennym czynnikiem predykcyjnym upośledzenia motorycznego po udarze [
9 ]. Upośledzenie tej funkcji prowadzi do zmniejszenia sprawności manualnej, ograniczenia czynności życia codziennego i pogorszenia jakości życia. Po udarze okazuje się, że występują trudności z podstawowymi czynnościami, takimi jak gotowanie, pranie, sprzątanie i wiele innych [
10 ]. Szczególnie trudne są czynności wykonywane oburęcznie, wymagające dużej sprawności manualnej [
11] Siła chwytu dłoni (HSG) to kolejny parametr sprawdzający powrót siły mięśniowej. Jest to przydatny pomiar i biomarker prognostyczny po udarze mózgu. Wykonuje się je przy użyciu dynamometru firmy Jamar wraz ze standaryzowanym protokołem badania zatwierdzonym przez Amerykańskie Towarzystwo Terapeutów Ręki (ASHT) [
12 ,
13 ]. Upośledzenie funkcji motorycznych po udarze często objawia się spastycznością mięśni, co skutkuje gorszą regeneracją motoryczną dotkniętej kończyny. Głównym problemem w tym przypadku jest wzmożone napięcie mięśni, co wymaga sprawdzenia odporności mięśni na rozciąganie, ale także zakresu ruchu stawów (ROM) oraz bólu spowodowanego deformacjami i przykurczami
[ 14,15
] . Jedną z cech niedowładu połowiczego kończyny górnej jest brak indywidualnej ruchomości stawów. Występują trudności w kontrolowaniu ruchu kończyny podczas sięgania, co jest spowodowane nieprawidłowym wytwarzaniem momentu obrotowego i zaburzoną koordynacją międzystawową [
16 ,
17 ]. Zrozumienie i uwzględnienie tych różnych perspektyw może pomóc pracownikom służby zdrowia opracować bardziej kompleksowe i dostosowane do indywidualnych potrzeb podejście do rehabilitacji ręki u pacjentów po udarze. W diagnostyce fizjoterapeutycznej oprócz testów i wag wykorzystuje się instrumenty. Taśmy centymetrowe i goniometr przeznaczone do pomiaru są powszechnie dostępne i proste w obsłudze [
18 ]. Konieczność uzyskania dokładnych wyników doprowadziła do rozwoju wielu narzędzi stosowanych w diagnostyce pacjentów po udarze mózgu, m.in. dynamometrów ręcznych, czujników haptycznych, systemów śledzenia pozycji, ruchu skokowego oraz wykorzystania sztucznej inteligencji. Pomiar dłoni jest niezbędny w procesie diagnostycznym w kontekście umożliwienia indywidualizacji terapii [
19 ,
20 ,
21 ,
22 ].
Dla utrzymania zdrowia pacjenta po udarze mózgu istotne jest jak najszybsze rozpoczęcie rehabilitacji, a po zakończeniu rehabilitacji szpitalnej ciągłe monitorowanie stanu pacjenta i rehabilitacja po opuszczeniu szpitala [
23 ]. Intensywność rehabilitacji koreluje z lepszymi wynikami rehabilitacji szpitalnej. Większe dawki terapii (zwiększona intensywność) podczas rehabilitacji stacjonarnej wpływają pozytywnie na miernik niezależności funkcjonalnej (FIM), prowadząc do wzrostu jego poziomu [
24 ]. Pomimo powszechnego dostępu do skal i testów do pomiaru dłoni i ramion, nie ma ogólnej zgody co do tego, które środki są najlepsze do oceny terapii pacjentów po udarze mózgu w fazie przewlekłej. Bushnell i in. zalecają stosowanie skali Fugl-Meyera Upper Extremity, Testu Funkcji Motorycznych Wolfa i Testu Ramion Action Research do pomiarów kończyn górnych i dłoni [
25 ]. Podkreślają, że skala Fugl-Meyera kończyn górnych powinna być podstawową miarą wyniku w przewlekłej fazie udaru. W ostrej i podostrej fazie udaru nie ma jasnych procedur określających, jakie działania należy podjąć w celu oceny wyników leczenia. Ten brak jasności prowadzi do rozbieżności między dowodami a praktyką w zakresie stawiania diagnoz ręcznych [
26 ]. Ponadto Murphy i wsp. w 2021 r. zatwierdzili stosowanie u pacjentów skali Fugl-Meyera Upper Extremity oraz testu Action Research Arm Test [
26 ].
Ograniczenia kończyn górnych, deficyty motoryczne i porażenie połowicze występują u ponad 80% pacjentów po udarze [
27 ]. Upośledzenia te wpływają na koordynację i sprawność manualną, które odgrywają kluczową rolę w codziennym życiu i funkcjonowaniu [
28 ]. Około 67% osób, które przeszły udar z powikłaniami, nadal nie może używać ręki, nawet cztery lata po zdarzeniu [
29 ]. Spastyczność kończyn górnych, która może rozwinąć się po udarze mózgu, dotyka 17–40% osób [
30 ,
31 ]. Podczas przywracania funkcji motorycznych po udarze mózgu w mózgu zachodzą mechanizmy reorganizacji kory mózgowej i plastyczności synaptycznej. Obie półkule mózgowe biorą udział w tych procesach reorganizacji [
32 ]. Ich aktywność jest najwyższa w ciągu pierwszych kilku miesięcy po chorobie [
27 ,
32 ]. Wyjątkowy okres krytyczny, zwany także okresem wrażliwości, obejmuje pierwsze trzy miesiące po udarze, podczas których możliwy jest całkowity powrót do zdrowia [
33 ].
Ograniczona ruchliwość rąk wiąże się z trudnościami w wykonywaniu codziennych zadań. Wyzwania związane z chwytaniem przedmiotów, przenoszeniem, manipulowaniem, koordynacją ruchów ręka-palce i utrzymywaniem zręczności są zarówno przeszkodami, jak i celami rehabilitacji [
34 ,
35 ]. Nawet do 12 miesięcy po udarze codzienne korzystanie z chorej kończyny górnej jest trzykrotnie rzadsze w porównaniu ze zdrową kończyną [
36 ].
Istnieje potrzeba zrozumienia oceny warunków fizycznych i fizjologicznych oraz związanych z tym pomiarów dłoni pacjenta po udarze. Istnieje różny stopień samoistnej poprawy niedowładu ramienia w ciągu pierwszych miesięcy po udarze. Ocenę poprawy stanu fizycznego i funkcji ręki pacjenta po 6 miesiącach można przewidzieć na podstawie wyników deficytów motorycznych występujących po 1 miesiącu hospitalizacji, pomimo kolejnych 5 miesięcy rutynowej rehabilitacji [
30 ]. Złożoność biomechaniczna dłoni znajduje odzwierciedlenie w dużej części kory ruchowej mózgu odpowiedzialnej za kontrolowanie ruchów dłoni. Precyzja kontroli ruchu ręki w dużym stopniu zależy od nienaruszonego układu korowo-rdzeniowego [
37 ,
38 ,
39 ]. Rehabilitacja ręki opiera się na ruchu motorycznym, który odgrywa ważną rolę w korze ruchowej mózgu [
40 ]. Droga korowo-rdzeniowa (kompensacyjne gałęzie drogi korowo-rdzeniowych) rozgałęzia się w wielu odcinkach rdzenia kręgowego i unerwia więcej mięśni proksymalnych niż dystalnych, z przewagą zginaczy, ale jest mało rozdzielcza i unerwia także prostowniki palców i dłoni. Powoduje to nieprawidłowe mimowolne sprzężenie między wizytą barkową a zgięciem nadgarstka/palca (synergia zgięcia), a także osłabienie mięśni będących prostownikami stawów dystalnych. Skutkuje to znacznym ograniczeniem ruchu otwierania dłoni [
41 ,
42 ].
Zdolność aktywnego prostowania palców do 7 dni po udarze jest częścią prognozy powrotu ruchomości kończyny górnej. Kluczowe jest także niezależne wyprostowanie nadgarstka i każdego palca, co wiąże się z integralnością drogi korowo-rdzeniowej. Czynnikiem prognostycznym jest także ruch odwiedzenia nieobecności w ciągu 72 godzin, wyprost kciuka oraz ruch zamykania i otwierania dłoni [
43 ,
44 ,
45 ,
46 ,
47 ]. Ten ostatni ruch reprezentuje ruch wielopalcowy, co jest istotne ze względu na częste upośledzenie koordynacji wielopalcowej u pacjentów po udarze mózgu [
48 ]. Carpinella i in. wykazali, że niewystarczające wyprostowanie palców wynika z dwóch współistniejących przyczyn: zmienionych neurofizjologicznych mechanizmów kontrolnych i mechanicznego ograniczenia ruchu wyprostu [
49 ]. Ograniczenia mechaniczne mogą być spowodowane zanikiem mięśni prostowników, przykurczem mięśni zginaczy, zwiększoną sztywnością bierną tkanki mięśniowej lub skróceniem włókien mięśniowych. Zaburzenia neurofizjologiczne mogą wynikać ze spastyczności mięśni zginaczy, osłabienia mięśni prostowników lub nadmiernego skurczu mięśni prostowników i zginaczy [
49 ,
50 ,
51 ,
52 ,
53 ,
54 ]. Rehabilitacja robotyczna może prowadzić do złagodzenia występowania spastyczności stawu nadgarstkowego [
55 ]. Przywrócenie prawidłowego napięcia mięśniowego jest czynnikiem predykcyjnym, wyznaczającym pierwszy etap zdrowienia od początku choroby [
56 ]. Naukowcy wskazują, że etapy rekonwalescencji po udarze Brunnstroma są przydatne w ocenie powrotu do zdrowia motorycznego u pacjentów po udarze. Skala składa się z siedmiu etapów, informujących o stanie pacjenta [
57 ,
58 ].
Rosnąca dyskusja na temat doboru i prawidłowego wykonywania pomiarów oceniających stan funkcjonalny pacjenta i obiektywne wyniki leczenia przyspiesza rozwój medycyny precyzyjnej w dziedzinie rehabilitacji. Alfano i in. wyjaśnić medycynę precyzyjną na przykładzie leczenia i rehabilitacji onkologicznej, powiązując właściwe leczenie z pacjentem, określając dokładną analizę i lokalizację choroby oraz charakterystykę pacjenta. Medycyna precyzyjna może pozytywnie wpłynąć na rehabilitację, zmniejszając ogólne cierpienie pacjentów spowodowane chorobą i pomagając w utrzymaniu jakości ich życia, takiej jak funkcjonowanie, zdolność do pracy i aktywne uczestnictwo w społeczeństwie [
59 ]. Medycyna precyzyjna nie jest jednak tak szeroko rozwinięta w dziedzinie rehabilitacji. W przyszłości identyfikacja i połączenie biomarkerów powstających w udarze mózgu może odpowiedzieć na pytania dotyczące wyboru odpowiedniego leczenia i ryzyka powikłań choroby naczyniowo-mózgowej [
60 ], co z kolei będzie miało wpływ na ocenę funkcjonalną i terapię rehabilitacyjną dostosowaną do możliwości pacjenta .
Głównym celem rehabilitacji jest poprawa jakości życia pacjentów po udarze mózgu. Jakość życia jest związana z postrzeganiem wpływu choroby na aktywność fizyczną, aktywność emocjonalną i funkcjonowanie społeczeństwa [
61 ,
62 ]. Właściwą obserwację powrotu do zdrowia przeprowadza się zgodnie z Międzynarodową Klasyfikację Funkcjonowania, Niepełnosprawności i Zdrowia (ICF) [
63 ]. ICF wyróżnia dwa główne ramy: Funkcjonowanie i Niepełnosprawność, które obejmuje kategorie Struktury Ciała oraz Aktywność i Uczestnictwo, a także drugi czynnik kontekstowy obejmujący czynniki środowiskowe i osobiste [
64 ]. Celem ram stosowanych w ICF jest ujednolicenie opisu stanu zdrowia dokonywanego przez klinicystów zajmujących się rehabilitacją [
65 ]. Badacze systematyzujący i dokonujący przeglądu miar wyników rehabilitacji zwracają uwagę, że brakuje instrumentów pozwalających na ocenę rzeczywistych wyników. Wskazują, że należy opracować nowe narzędzia oceny wyników, przydatne w różnych populacjach pacjentów [
66 ]. Właściwości psychometryczne, w tym niezawodność, trafność i responsywność, są istotnymi koncepcjami przy wyborze odpowiednich i skutecznych miar i instrumentów wyników [
67 ]. Według van Gilsa (2018) ocena kończyny górnej u pacjenta po udarze powinna uwzględniać jednocześnie upośledzenie motoryczne, aktywność i sprawność oburęczną [
68 ]. Test Fugl-Meyera do badania pacjentów po udarze jest częstym wyborem wśród badaczy. Dobrym miernikiem jest śledzenie zmian funkcji powracającej w kończynie górnej [
69 ].
2. Diagnoza, pomiary dłoni i obsługa instrumentów
Wybór skal do oceny poudarowych zaburzeń motorycznych jest szeroki i obejmuje różnorodne ruchy, w tym ruchy synergistyczne, zdolności manualne, chwytanie, manipulację przedmiotami o różnej wielkości, zakres ruchu w stawach itp. (ryc. 3) [
70 ] Niektóre z tych miar mają ograniczoną czułość lub wykazują efekt pułapu, gdyż nie są w stanie uchwycić całego zakresu utraty wartości. Dodatkowo pomiary wykonywane przez różnych pracowników medycznych mogą prowadzić do różnych wyników i zmniejszenia obiektywizmu [
4 ,
71 ,
72 ,
73 ].
W literaturze dotyczącej rehabilitacji poudarowej opisano wiele narzędzi i skal służących do oceny pacjentów i ich powrotu do zdrowia [
71 ]. Analiza narzędzi stosowanych w badaniach udaru ujawnia znaczną różnorodność w wyborze środków oceny i metod ich stosowania [
74 ]. Nierzadko można spotkać badania wykorzystujące niestandardowe i niezwalidowane środki [
75 ].
U pacjentów po udarze występują różne etapy powikłań kończyn górnych i dłoni, co opisano w etapach rekonwalescencji Brunnstroma. Etapy rekonwalescencji po udarze Brunnstroma, opisane w 1966 roku, są nadal jednym z najczęściej stosowanych standardów oceny klinicznej po udarze. Należy pamiętać, że skala ma charakter subiektywny, a jej ocena w dużej mierze zależy od doświadczenia lekarza. Brak doświadczenia może przełożyć się na niespójności w wynikach oceny dokonywanej na podstawie skali [
76 ]. Początkowo dłoń pacjenta wykazuje zmniejszone napięcie mięśniowe, zwane porażeniem wiotkim, po którym następuje spastyczność, aż do rozwinięcia się selektywnej kontroli ruchu. Kiedy napięcie mięśni normalizuje się, przywracany jest normalny ruch [
58 ]. Czas potrzebny do przejścia od fazy wiotkiej do fazy wzmożonego napięcia mięśniowego jest różny, ale zazwyczaj waha się od jednego do trzech tygodni po wystąpieniu udaru [
77 ]. U niektórych pacjentów porażenie wiotkie może utrzymywać się przez lata i definiuje się je jako przedłużoną hipotonię mięśni trwającą dłużej niż dwa miesiące po udarze [
78 ]. Utrzymujące się porażenie wiotkie utrzymujące się przez ponad rok po udarze wiąże się z gorszymi i wolniejszymi wynikami rehabilitacji chorej ręki [
78 ,
79 ]. Porażenie wiotkie jest związane z zespołem dolnych neuronów i obwodowego
układu nerwowego i oprócz zmniejszonego napięcia mięśniowego może charakteryzować się zanikiem mięśni, osłabieniem i brakiem odruchów [
80,81 ].
Spastyczność jest zjawiskiem, w którym zaburzona jest integracja odpowiedzi motorycznej układu nerwowego na bodźce zmysłowe. Zwykle definiowana jako zależny od prędkości wzrost napięcia mięśni, spastyczność jest związana z nadwrażliwością łuku odruchowego. Jest składnikiem zespołu górnego neuronu ruchowego, którego objawami mogą być wzmożone napięcie, przykurcze i zaburzenia ruchu. Spastyczność odnosi się do zmian zachodzących w ośrodkowym układzie nerwowym [
82 ,
83 ].
W przypadku pacjentów z zespołem cieśni nadgarstka stosowano skalę kwestionariusza cieśni nadgarstka (CTQ), nazywaną w części literatury Bostonem Kwestionariuszem Tunelu Nadgarstka (BCTQ) [
129 ]. Kwestionariusz oceny nadgarstka/dłoni oceniany przez pacjenta (PRWE) ma modyfikację nieuwzględnioną w tabeli, zwaną kwestionariuszem oceny nadgarstka/dłoni ocenianej przez pacjenta (PRWHE), która dodatkowo uwzględnia kwestie estetyczne [
128 ]. Według naszej najlepszej wiedzy Skala Historyczno-Obiektywna (Hi-Ob) została z powodzeniem zastosowana u pacjentów z zespołem cieśni nadgarstka [
152 ], ale nie ma zastosowania u pacjentów neurologicznych po udarze.
Inne często stosowane ręczne skale do pomiaru zapalenia stawów w reumatoidalnym zapaleniu stawów i chorobie zwyrodnieniowej stawów, które nie są ujęte w powyższej tabeli, to kwestionariusz oceny stanu zdrowia (HAQ), skala pomiaru wpływu zapalenia stawów (AIMS), sekwencyjna ocena sprawności zawodowej (SODA), australijski/kanadyjski wskaźnik choroby zwyrodnieniowej dłoni, i test zdolności chwytu (GAT) [
87 ,
96 ]. Testy te skupiają się bardziej na ogólnym stanie dłoni niż na funkcjonalności i precyzji [
87 ]. Ze względu na charakter chorób, w przypadku których stosuje się te miary wyniku terapii. Dodatkowo istnieje kilka testów zręczności: test zręczności małych części Crawforda, test zręczności z perforacją, test szybkości manipulacji w Minnesocie, test podnoszenia Moberga i test zręczności palców O'Connora [
96 ].
W przypadku skali Ashwortha i Tardieu pomiary kliniczne nie pozwalają na rozróżnienie neuronalnych i nieneuronalnych (obwodowych) aspektów spastyczności. Częściej sugerowanym wyborem jest użycie Zmodyfikowanej Skali Tardieu (MTS). Chociaż Skala Ashwortha i Zmodyfikowana Skala Ashwortha podlegają ograniczeniom w zakresie subiektywności, są nadal w powszechnym użyciu, ze względu na ich szybkość i łatwość wykonania [
153 ,
154 ]. Stwierdzono, że Skala Tardieu jest lepsza od Skali Ashwortha w sprawdzaniu wyniku leczenia w porównaniu ze spastycznością. Wyniki te są zgodne z definicją spastyczności Lance’a, skutecznie odróżniając ją od przykurczu [
155 ,
156 ]. Pomimo powszechnego stosowania AS, MAS i MTS, w większości wykazują one niską lub umiarkowaną niezawodność [
121 ,
157 ]. Australijska Skala Oceny Spastyczności (ASAS) powstała w odpowiedzi na większą zawodność i dokładność skal przeznaczonych dla mięśni spastycznych. Łączy w sobie najlepsze aspekty Skali Tardieu i Zmodyfikowanej Skali Tardieu, a punktacja jest podobna do Zmodyfikowanej Skali Ashwortha. Warto zauważyć, że istnieje znaczne podobieństwo pomiędzy wszystkimi skalami oceniającymi napięcie mięśni [
158 ]. Obecnie klinicystom brakuje idealnego środka zaprojektowanego specjalnie dla pacjentów po udarze. Gdyby taki system miał zostać stworzony, powinien zawierać kryteria łatwości i szybkości wykonania, akceptacji przez pacjentów i wykonujących badania badaczy, a także niezawodność i szybkość reakcji na zmiany kliniczne [
71 ]. Pomiary napięcia mięśniowego są niezbędne klinicystom podczas sprawdzania wyników rehabilitacji pacjentów ze spastycznością poudarową. Można je wykorzystać do sprawdzenia skuteczności określonych technik rozciągania, ćwiczeń funkcjonalnych lub terapii uzupełniających, takich jak Kinesiotaping [
159 ].
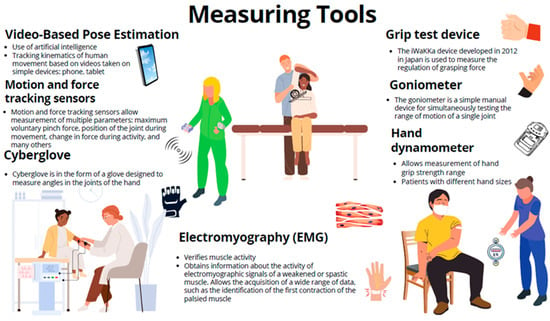
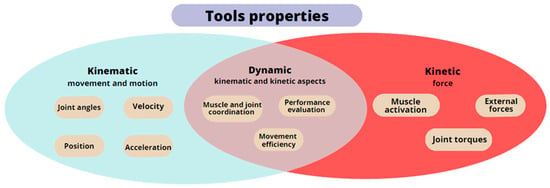
Aby zwiększyć wiarygodność wyników pomiarów, lekarze stopniowo sięgają po specjalistyczne instrumenty (
ryc. 2 i
ryc. 3 ). Przyrządy te są podzielone na kategorie na podstawie konkretnych mierzonych właściwości: kinematyczne, kinetyczne i dynamiczne. Właściwości kinematyczne skupiające się na ruchu i ruchu można mierzyć za pomocą goniometrów, systemów przechwytywania ruchu i inercyjnych jednostek pomiarowych. Właściwości kinetyczne sił działających na dłoń i biorących udział w ruchu można ocenić za pomocą czujników siły, dynamometrów (urządzenia do badania przyczepności i dynamometrów ręcznych) oraz urządzeń miograficznych (elektromiografia i mechanomiografia). Właściwości dynamiczne obejmujące zarówno aspekty, jak i funkcję dłoni podczas czynności, można mierzyć za pomocą rękawiczek oprzyrządowanych (CyberGlove), urządzeń robotycznych i zintegrowanych systemów wizyjnych opartych na skanerach 3D, takich jak Microsoft Kinect lub Leap Motion [
21 ].
Rycina 2. Narzędzia pomiarowe stosowane jako miary wyników w rehabilitacji ręki po udarze.
Rysunek 3. Schemat właściwości ręcznych narzędzi pomiarowych.
Elektromiografia (EMG) to niezawodne narzędzie wykorzystywane przez klinicystów w celu potwierdzenia poprawy leczenia lub rehabilitacji podczas oceny napięcia mięśniowego. Instrument ten umożliwia gromadzenie informacji na temat aktywności elektromiograficznej mięśni spastycznych, oferując wgląd, taki jak identyfikacja pierwszego skurczu mięśni sparaliżowanych [
160 ,
161 ]. EMG można wykorzystać do rejestracji aktywności mięśni przedramienia i dłoni podczas rutynowych codziennych czynności [
162 ].
Pacjenci po udarze mogą przyjmować strategie kompensacyjne, gdy napotykają trudności w wykonywaniu określonych zadań motorycznych lub utrzymywaniu określonych pozycji ciała [
163 ]. Może to stanowić wyzwanie dla klinicystów, którzy mogą przeoczyć te aspekty przy ocenie upośledzenia. Stosowanie EMG pozwala na bardziej wszechstronną, ilościową ocenę, która obejmuje wykrywanie strategii kompensacyjnych [
164 ].
Powierzchniowe EMG (sEMG) polega na umieszczeniu elektrod na powierzchni skóry w celu rejestracji sygnałów ze wszystkich włókien mięśniowych [
162 ]. Te nieinwazyjne elektrody są łatwe w użyciu, ale ich zastosowanie ogranicza się do powierzchownych mięśni [
165 ]. sEMG można wykorzystać do rozpoznawania gestów dłoni i monitorowania uczenia się motorycznego [
166 ]. Oprócz elektrod powierzchniowych do rejestrowania sygnałów aktywności mięśni z określonych włókien mięśniowych można stosować elektrody nieruchome i cienkodrutowe (Fw-EMG). Elektrody stałe umożliwiają rejestrację aktywności mięśni głębokich. Personel medyczny musi posiadać szczegółową wiedzę z zakresu anatomii i zostać przeszkolony w zakresie umieszczania elektrod, ponieważ elektrody te wprowadza się bezpośrednio do mięśni [
167 ]. Wykazano, że informacje uzyskane w wyniku biofeedbacku na podstawie EMG przyczyniają się do zwiększonej poprawy motorycznej u pacjentów [
168 ].
Ocena neurofizjologiczna z wykorzystaniem mapowania kory mózgowej i potencjałów wywołanych może pomóc w dostosowaniu strategii terapeutycznych i wyborze odpowiedniej terapii dla pacjenta po udarze. Xia i wsp., 2022, wykorzystując mapowanie korowe, wykazali, że aktywny ruch kończyn górnych powoduje większą aktywację kory mózgowej niż bierny ruch kończyny. Zostało to potwierdzone zarówno w populacji po udarze mózgu, jak i u osób zdrowych. Mając możliwość przeprowadzenia oceny neurofizjologicznej, celowe jest zindywidualizowanie najlepszej strategii terapeutycznej [
169 ]. Rehabilitacja neurologiczna to dziedzina, która stale się rozwija. Opracowane interfejsy mózg-komputer lub mózg-maszyna (BCI/BMI) przekładają elektryczną, magnetyczną lub metaboliczną aktywność mózgu na sygnały sterujące urządzeniami takimi jak komputer. Jedna ze strategii ma na celu ominięcie uszkodzonych szlaków korowo-rdzeniowych, aby umożliwić ciągłą i trwałą kontrolę urządzeń [
170 ]. Dzięki interfejsom mózg-maszyna pacjenci neurologiczni po udarze zyskują możliwości mobilności, ruchu i uczenia się motorycznego. Interfejsy mogą również stanowić część wskaźników, według których oceniane będą określone wykonane ruchy [
171 ].
Rośnie zainteresowanie wykorzystaniem technologii sztucznej inteligencji do szacowania pozycji w śledzeniu ruchu. Takie podejście umożliwia monitorowanie kinematyki w filmach, rejestrując precyzyjną kontrolę motoryczną w słabszych dłoniach, palcach i ramionach [
172 ]. Cherry-Allen i wsp., 2023 sugerują, że szacowanie pozycji w oparciu o sztuczną inteligencję oferuje klinicystom prostsze narzędzie do gromadzenia danych ilościowych na temat jakości ruchu, stanowiąc bardziej opłacalną alternatywę dla drogich i wyrafinowanych urządzeń wyposażonych w oprogramowanie do analizy ruchu 3D [
172 ] Znaczenie oceny pozycji zawodowej w rehabilitacji neurologicznej po udarze zostało potwierdzone przez ekspertów z Okrągłego Stołu ds. Rekonwalescencji i Rehabilitacji po udarze [
173 ].
Dostępne są różne instrumentalne miary spastyczności, zwiększające obiektywność ocen i ich wyników. Przykładami są Instrumentalna Skala Tardieu, która wykorzystuje sygnały elektrofizjologiczne podczas mobilizacji kończyn i rejestruje aktywność mięśni za pomocą EMG. Instrumentalna skala wahadłowa wykorzystuje czujniki do śledzenia ruchu kończyn, obserwując czynniki, takie jak przemieszczenie kątowe, prędkość i przyspieszenie, które są trudne do oceny wizualnej [
174 ]. Ultrasonograficzna elastografia mięśni umożliwia mechaniczne badanie elastyczności tkanki, natomiast Instrumentalna Skala Wahadła mierzy progową reakcję odruchową kręgosłupa za pomocą EMG. Dlatego obiecujące wydaje się wykorzystanie instrumentalnych wersji tradycyjnych skal klinicznych w celu zminimalizowania ograniczeń procedur manualnych [
175 ,
176 ].
Powszechnym narzędziem do oceny zakresu ruchu jest goniometr [
177 ], standardowe narzędzie ręczne do pomiaru pojedynczego stawu [
18 ]. W badaniach coraz rzadziej wykorzystuje się goniometr ręczny. Badanie zakresu ruchu stawu za pomocą goniometru częściej odnotowuje się w badaniach technicznych, gdzie istotna jest szczegółowa analiza ruchu i porównanie goniometrii, a nie tylko powrót do zdrowia i funkcji kończyny górnej [
18 ,
21 ]. Goniometr ręczny w dalszym ciągu cieszy się uznaniem doświadczonych klinicystów [
178 ]. Siłę mięśni powszechnie badano przez wiele lat za pomocą skali Lovetta. Hidayat i wsp., 2016 monitorowali siłę mięśni palców u pacjentów po udarze. Stworzyli system łączący aplikację desktopową z opaską MYO. Umożliwiło to zmierzenie siły mięśni i ruchomości przedramienia pacjenta, w tym rąk. Wyświetlane pomiary są przydatne dla pacjenta, który nie musi przebywać w szpitalu, aby je uzyskać, a także wykazują większą obiektywność wyników [
150 ]. Robotykę rehabilitacyjną można wykorzystać do ilościowego określenia funkcji kończyny górnej jako metodę pomiaru. Wyniki mogą zapewnić czułe i obiektywne wyniki rehabilitacji po udarze [
57 ]. Naukowcy coraz częściej sięgają po innowacyjne rozwiązania, takie jak CyberGlove, który mierzy kąty w stawach dłoni, czy czujniki siły, które mierzą siłę wywieraną podczas zadań takich jak szczypanie. Czujniki te można wykorzystać do oceny parametrów, takich jak maksymalna dobrowolna siła ściskająca (MPF) [
33 ]. Do pomiaru siły chwytu można używać dynamometrów ręcznych [
179 ]. Na rynku dostępnych jest coraz więcej instrumentów umożliwiających obiektywną ocenę wyników rehabilitacji czy zmian w stanie pacjenta. Jednym z takich urządzeń jest iWakka, które zostało opracowane w Japonii w 2012 roku w celu pomiaru regulacji siły chwytu [
180 ]. W przechwytywaniu ruchu 3D można zastosować różne strategie, aby poprawić jakość uzyskanych danych. Coraz częściej stosuje się coraz mniejsze czujniki ruchu w celu uzyskania dokładnych pomiarów funkcji ręki po udarze [
181 ]. Bachtin i in., 2019 wykorzystali niedrogi akcelerometr MEMS. Umieszczono go na przedramieniu pacjenta, aby umożliwić pomiar kąta pochylenia przedramienia względem wektora grawitacji. System posiadał wygodę przesyłania danych inercyjnych do urządzeń zewnętrznych za pośrednictwem Bluetooth [
182 ]. Ważne jest, aby wziąć pod uwagę również mniej oczywiste parametry, takie jak obrzęk dłoni po udarze, który jest częstym objawem zmiennym w czasie i mogącym wpływać na wyniki leczenia [
183 ,
184 ].
This entry is adapted from the peer-reviewed paper 10.3390/jcm12237497