Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Mycology
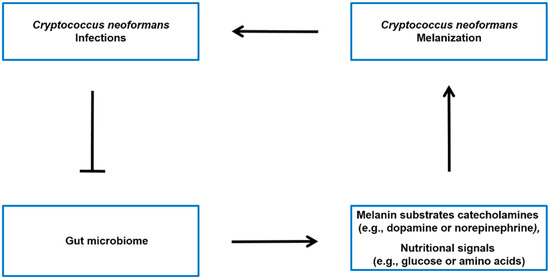
新型隐球菌属复合体(C. neoformanss SC)的真菌病原体是免疫功能低下个体真菌性脑膜炎的主要原因。与与人类疾病相关的其他黑色素微生物一样,C. neoformanss SC的细胞壁相关黑色素是有助于其逃避宿主免疫反应能力的主要毒力因子。黑色素底物的水平和黑色素形成的调节可能受到微生物群-肠道-脑轴的影响。此外,最近的研究表明,C. neoformans感染会导致人类肠道微生物组生态失调。
- cryptococcal meningitis
- melanin
- catecholamines
- nutritional signals
- microbiota–gut–brain axis
1. 简介
属于新型隐球菌属复合体(C. neoformanss SC)的菌株是人类致病真菌,属于担子菌门[1,2]。虽然它拥有明确定义的双极交配系统,由两种不同的交配类型MATa和MATα组成[3,4],但它也能够在相同交配类型的细胞内进行自受精[5,6]。C. 新福曼斯SC真菌广泛分布在环境中,特别是在鸟粪、土壤和树木中[7]。C. 新福曼斯SC真菌对免疫功能低下的宿主(包括HIV/AIDS人群和器官移植受者)尤其危险,因为它们容易引起脑膜脑炎[8,9,10,11,12,13]。例如,在HIV/AIDS患者中,C. neoformans SC真菌每年引起约223,100例新发病例和181,000例死亡[14,15]。重要的是,根据世界卫生组织(WHO)的确定,这些物种被归类为影响人类的最优先真菌病原体组中的四个物种之一。C. neoformans感染通常通过吸入环境中的真菌孢子或干燥的酵母细胞而发生[16,17],以及通过皮肤伤口定植[18]。这些物种能够克服宿主的防御并进入血液,在那里它们可以播散到包括CNS在内的各种器官,引起脑膜炎[16,19]。
隐球菌性脑膜炎的诊断通常包括对临床症状和体征的全面评估,以及使用各种诊断方法[21,31,32,33]。这些方法包括评估患者的病史并进行体格检查以确定与隐球菌性脑膜炎相关的症状。此外,通常进行腰椎穿刺以收集和分析脑脊液 (CSF) 是否存在隐球菌属。实验室检查,包括脑脊液的印度墨水染色、通过 PCR 培养隐球菌属或抗原检测,也用于确认隐球菌感染的存在。各种神经成像技术,如计算机断层扫描(CT)成像和磁共振成像(MRI),可用于检查大脑是否有脑膜炎或其他异常的迹象。这些方法的整合对于准确诊断和排除其他潜在原因至关重要。研究表明,肠道微生物组的组成可能在隐球菌性脑膜炎的诊断中具有潜在作用。研究表明,肠道微生物组的改变可能与真菌感染有关,包括隐球菌属[34]。
C. 新福曼斯SC真菌能够损害宿主对真菌抗原的准确识别,并逃避宿主吞噬细胞(即巨噬细胞或树突状细胞)、T淋巴细胞和B淋巴细胞、先天淋巴细胞和外周细胞因子协调的免疫应答[35,36]。此外,C. neoformans SC真菌利用黑色素的产生来逃避宿主免疫并增强其在宿主中的感染性。细胞壁中的C. neoformans黑色素是主要的毒力因子,具有多种功能,例如防止氧化应激,降低抗真菌药物的效率以及影响与吞噬细胞的相互作用[16,37,38]。研究人员认为,黑色素可能是开发针对隐球菌属引起的感染的药物的潜在靶标[20,39]。C. neoformans漆酶的一个显着特征是它无法从内源性合成的化合物(如酪氨酸)中产生黑色素色素。使用酪氨酸产生黑色素是这些微生物的典型特征[40]。在脑组织中,C. neoformanss SC的真菌通过漆酶(Lac1和Lac2)氧化外源儿茶酚胺(即多巴胺、去甲肾上腺素和肾上腺素)产生黑色素色素[41,42,43]。C. neoformmans SC的神经嗜性与大脑中儿茶酚胺的存在以及CNS中低浓度的葡萄糖显着相关。这是因为在这些条件下,漆酶的产生被过度调节[42,44,45]。
2. C. neoformans感染导致肠道微生物组破坏
我们对肠道微生物群的理解和分析的最新进展揭示了改变对人类健康的重大影响。肠道微生物群是一个复杂多样的微生物生态系统,在宿主生理的各个方面起着至关重要的作用。它积极参与宿主的免疫应答,影响新陈代谢,促进生物合成,并防御致病酵母菌感染[48,49,50,51]。在这种情况下,已经发现肠道细菌微生物群的组成会影响小鼠机会性人真菌病原体烟曲霉感染期间肺部IL-17反应的产生。具有特定肠道细菌组成的小鼠表现出更强大的IL-17反应,这对于对抗真菌感染至关重要[52]。
最近,Li及其同事报告说,C. neoformans感染诱导了人类肠道微生物群的改变[34]。作者进行了α和β多样性分析,将隐球菌性脑膜炎患者的肠道微生物群与健康对照进行比较。结果显示,与健康对照组相比,隐球菌性脑膜炎患者的α多样性显着降低,表明肠道生态失调。他们总共在这两组之间鉴定了72种不同丰度的细菌和8种不同丰度的真菌物种。
3. C. 新甲虫在人脑组织中的黑色化
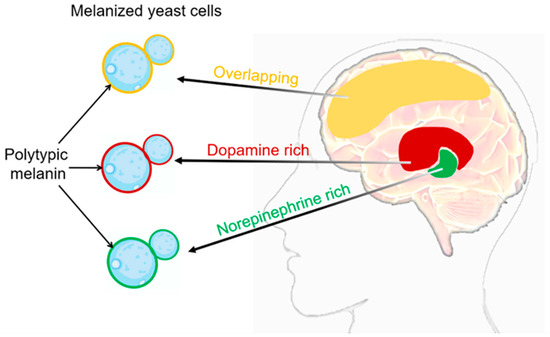
对于新生梭菌SC真菌,有助于发病机制的细胞表面特征包括黑色素在细胞壁中的沉积[55,56]。C. neoformanss SC中的黑色素沉积取决于其细胞壁的组成和柔韧性[57]。细胞壁内的黑色素沉积为病原体提供了几个优点[58]。首先,黑色素作为对宿主免疫反应的保护屏障,包括免疫细胞的吞噬作用。黑色素已被证明可以抑制活性氧的产生并降低抗真菌剂的活性,从而增加C. neoformanss SC对宿主防御的抵抗力。此外,黑色素与C. neoformansSC在宿主内的传播有关。在包括大脑和肺在内的各种器官中都检测到黑色化真菌细胞,表明黑色化在不同组织中感染的侵袭和建立中起作用[59]。C. neoformans在感染期间黑色化的主要迹象来自耐酸黑色素幽灵颗粒的鉴定。这些颗粒是从受感染的动物和人体组织以及用组织匀浆培养在琼脂平板上培养的细胞中分离出来的[60,61]。哺乳动物的神经系统是儿茶酚胺形式的前体的丰富来源,儿茶酚胺是含氮的二酚化合物。这些儿茶酚胺包括神经递质,如多巴胺、肾上腺素和去甲肾上腺素[62,63]。C. 新福曼斯SC真菌通过使用漆酶催化外源性儿茶酚胺底物的氧化来产生黑色素[64,65,66]。在隐球菌性脑膜炎患者的脑组织样本中检测到黑色化的新福曼梭菌细胞[60]。C. neoformansSC真菌在脑组织中合成的黑色素在不同的解剖区域可能有所不同,因为它能够同时结合多种儿茶酚胺(图2)。这是因为这些神经递质的相对比例在不同大脑区域之间可能有很大差异[62,63]。添加到介质中的基材的化学结构决定了合成颜料类型的可变性。值得注意的是,Baker等人对C. neoformanss SC利用人脑儿茶酚胺混合物(0.6 mM多巴胺,0.33 mM去甲肾上腺素和0.07 mM肾上腺素)产生多型黑色素的能力进行了重要观察。这种黑色素可防止紫外线和氧化剂。

图2. C.不同脑组织中的新形态黑色化。感染期间产生的黑色素组成表现出取决于组织的儿茶酚胺组成的变化。黑色素色素的体内合成极有可能是由各种前体化合物的聚合引起的[37,41]。脑中的儿茶酚胺分布:红色结构域代表富含多巴胺,绿色结构域代表富含去甲肾上腺素,黄色结构域代表多巴胺和去甲肾上腺素之间的重叠。在C. neoformanss SC的细胞壁中,不同大脑区域产生的不同类型的黑色素可以可视化为红色,绿色和黄色。
4. 肠道微生物组对新甲虫脑黑色化的可能影响
4.1. 肠道微生物组影响黑色素底物的水平
肠脑轴是连接肠道微生物组和中枢神经系统的双向通信系统[68,69]。人们普遍认为,肠道微生物组有能力影响大脑功能的各个方面,如情绪、行为和认知[70,71]。这被认为是通过不同的途径发生的,例如神经递质和其他信号分子的产生,这些信号分子可以影响中枢神经系统的功能[70,72]。虽然没有直接证据表明肠脑轴与新福曼梭菌黑色素的合成有关,但有证据表明肠道微生物组有可能影响儿茶酚胺的水平(图3),如多巴胺和去甲肾上腺素,它们是脑组织中新福曼梭菌SC菌株的黑色素底物。

This entry is adapted from the peer-reviewed paper 10.3390/ijms241713515
This entry is offline, you can click here to edit this entry!
