Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Veterinary Sciences
黄芩苷是在黄芩属黄芩(SBG)的干根中发现的最丰富的类黄酮之一。虽然黄芩苷被证明具有抗炎、抗病毒、抗肿瘤、抗菌、抗惊厥、抗氧化、保肝和神经保护作用,但其低亲水性和亲脂性限制了生物利用度和药理功能。因此,对黄芩苷的生物利用度和药代动力学的深入研究,有助于为疾病治疗的应用研究奠定理论基础。
- baicalin
- bioavailability
- drug interaction
- anti-inflammatory activity
- pharmacokinetics
1. 简介
黄芩属格奥尔基(SBG)属于黄芩属,主要生长在亚洲,包括中国、蒙古、日本、韩国和西伯利亚[1]。在中国,SBG被认为是一种正宗的传统药材,广泛生长在海拔60-2000米的沙漠地区和阳光充足的草坡上[2]。它主要分布在中国北方省份,如河北,山东,山西和内蒙古[3]。根据SBG的生长季节和周期特征,Xu等人(2020)确定秋季收获并栽培三年的SBG质量最佳[2]。SBG的主要活性成分包括黄芩苷、黄芩素、黄芩素、黄芩素、汉黄芩素和汉黄芩素[4]。在临床实践领域,黄芩经常用于治疗炎症性疾病、流感、腹泻、黄疸、头痛和腹痛[5]。SBG在减少各种疾病方面的广谱药理作用主要是通过调节宿主免疫[6]。此外,据报道,SBG具有增强免疫力、抗衰老、保护肝脏和抗骨质疏松症等作用[7,8]。
类黄酮是一类广泛分布在各种蔬菜和水果中的化合物[9]。食用富含类黄酮的水果和蔬菜可以降低炎症性疾病的风险[9]。体内和体外分析证实,某些类黄酮对疾病有治疗作用。例如,黄芩苷(7-葡萄糖醛酸、5,6-二羟基黄酮、C21H18O11)近年来已广泛用于药物制剂的开发及某些疾病的治疗[10]。黄芩苷,也称为黄芩素,是由黄芩素的C7羟基与葡萄糖醛酸结合形成的[10](图1)。黄芩苷在正常情况下为淡黄色粉末;味苦,不溶于醇类,溶于氯仿、硝基苯、二甲基亚砜等。[11,12,13]
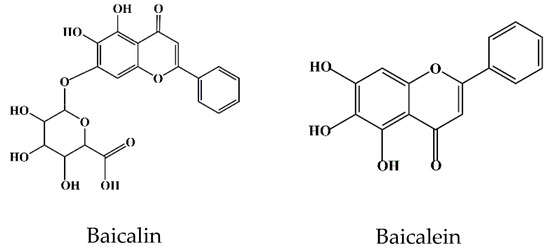
图1.黄芩苷和黄芩素的化学结构.
2. 黄芩苷的生物利用度
在药理学研究中,生物利用度是指药物被体循环吸收的程度,反映胃肠道吸收的药物占口服量的百分比[19]。通常,吸收率为1%的药物的渗透系数约为1.0×10−6厘米/秒。药物吸收率在1%至100%之间,范围为1.0×10−6至0.1cm/s,吸收小于1%的药物和肽的渗透系数低于1.0×10−7厘米/秒[20]。
其低水溶性 (67.03 ± 1.60 μg/mL) 和渗透率 (0.037 × 10−6CM/M)确定黄芩苷不能通过被动扩散到宿主细胞脂质双层中,这导致黄芩苷的吸收不良和生物利用度低[21]。相反,黄芩素是一种黄芩苷,具有良好的渗透性和亲脂性,可被胃肠道很好地吸收[22]。研究表明,黄芩苷和黄芩素在黄芩苷的吸收过程中存在相互转化[22,23,24]。特别是,在动物中给药后,黄芩素可以通过源自肠道细菌的β-葡糖醛酸酶水解为黄芩素,黄芩素可以通过体内循环的尿苷5′-二磷酸(UDP)葡糖苷酸转移酶(UGT)回收为黄芩苷[25]。这种相互转化最大限度地发挥了黄芩苷的全部药效学功能[25]。由于黄芩素比黄芩素吸收更好,黄芩素转化为黄芩素是黄芩素在肠道中吸收的关键步骤。此外,据报道,肠道微生物群与黄芩苷转化为黄芩素有关[26]。例如,与常规大鼠相比,无菌大鼠对黄芩素的肠道吸收显着降低[26],表明肠道菌群的存在有利于人体对黄芩素的吸收和利用。也就是说,只有一小部分黄芩苷作为原料被人体吸收,大部分被细菌水解成黄芩素,被肉体吸收。人血清白蛋白(HSA)是人体吸收和利用类黄酮(例如黄芩素、儿茶素、槲皮素等)的主要转运介质[27]。黄芩苷在宿主中的转运速率和体积分布取决于黄芩苷与HSA的结合程度[28]。特别是,根据时间-浓度曲线下的面积,黄芩苷的相对吸收率约为65%[29]。进一步的药代动力学分析表明,大鼠血清中黄芩苷的峰浓度低于黄芩素[30]。为了提高黄芩苷的生物利用度,研究人员专注于黄芩苷新配方的开发,如固体纳米晶纳米乳液、固液纳米颗粒、脂质体制剂、磷脂复合物水凝胶等。[31,32,33]。这些新技术和产品的应用开发旨在提高黄芩苷的溶解度和吸收性。
3.黄芩苷的毒性
清除药物的安全剂量范围和作用时间对药物特性至关重要,因为这些直接威胁动物的安全。确定黄芩苷的安全剂量范围及其作用持续时间在不同的动物和细胞模型中具有至关重要的意义[34]。为了研究黄芩苷是否参与肝胰岛素抵抗和糖异生活性的调节,一项体外研究表明,腹腔注射黄芩苷(50mg / kg)不仅导致肥胖小鼠(C57BL / 6J)的体重减轻和胰岛素抵抗(胰岛素抵抗的稳态模型评估,HOMA-IR),而且还降低了葡萄糖耐受不良和高血糖症。在这项研究中,他们还表明黄芩苷对小鼠的肝脏没有毒性[35]。结果表明,黄芩苷通过抑制肥胖小鼠肝脏中p-p38丝裂原活化蛋白激酶(MAPK)、磷酸化环腺苷3′,5′-单磷酸(cAMP)反应结合蛋白(p-CREB)、叉头转录因子叉头盒O1A(Foxo1)、过氧化物酶体增殖物激活受体γ共激活剂1α(PGC-1α)、磷酸烯醇丙酮酸羧激酶(PEPCK)和葡萄糖-6-磷酸酶(G6Pase)的表达,可有效缓解肥胖的发展。 肝细胞[35]。Shi等人(2020)进行的另一项研究表明,对乙酰氨基酚(APAP)诱导的小鼠肝毒性在给予黄芩素后6 h、12 h和18 h有效降低,给予40 mg/kg黄芩素的小鼠肝细胞坏死面积显着减少[36]。这些结果表明,安全剂量的黄芩苷不仅对小鼠没有细胞毒性,而且可以降低脂毒性。与此一致,据报道,黄芩苷可有效抑制用50、100和200mg/kg黄芩素治疗的鸡LPS诱导的肝炎的发生[37]。一项针对非酒精性脂肪性肝病(NAFLD)的氧化应激研究显示,根据CCK-0测定法测定,浓度范围为01.100nM至2μM的黄芩苷在24小时和48小时对HepG8细胞没有任何细胞毒性作用[38]。
黄芩苷对内质网(ER)应激有显著的抑制作用。例如,发现黄芩苷(12.5μM和25μM)可有效抑制ER应激标志物磷酸化肌醇需要酶1α(p-IRE1α)和反向棕榈酸(PA)诱导的细胞凋亡和活性氧(ROS)的表达[38]。主要机制可能是黄芩苷通过抑制ER应激和硫氧还蛋白相互作用蛋白(Txnip)/NLRP12炎症小体的活化来降低PA诱导的细胞毒性[39]。这些研究为黄芩苷的临床应用提供了新的理论依据,进一步完善了黄芩苷的细胞毒性研究。从毒理学角度来看,黄芩苷比黄芩苷毒性更大[39]。有趣的是,肠道微生物可能对黄芩苷引起的肝毒性有保护作用[39]。为了支持这一点,黄芩素与粪便酶孵育以剂量依赖性方式降低了对肝癌细胞(HepG2)细胞的细胞毒性,这表明人粪便酶从黄芩苷转化为黄芩素可防止黄芩苷诱导的对HepG2细胞的细胞毒性[40,41]。这些研究为黄芩苷的临床应用铺平了新的理论基础,进一步完善了黄芩苷的细胞毒性研究。
4. 黄芩苷的治疗效果
4.1. 黄芩苷对肝炎的影响
TNF-α是一种重要的细胞因子,参与肥胖、胰岛素抵抗、高脂血症和NAFLD等代谢性疾病[59]。肝损伤过程中TNF-α的产生导致IL-1β和IL-6的释放,IL-60β和IL-4介导炎症反应[4]。肝毒性可通过肝细胞中脂质过度积累来激活TLR61[4]。TLR88激活后,大量的MyD62聚集了NF-κB和MAPK[1]。NF-κB和MAPK的聚集促进TNF-α、IL-6β、IL-63等促炎因子的表达和促炎细胞的浸润,进一步加重肝损伤[<>]。
4.2. Role of Baicalin in Rheumatoid Arthritis
Rheumatoid arthritis (RA) is a chronic inflammatory disease in the synovium, which can lead to cartilage and bone damage and disability [68]. Factors involved in the development of diseases include genetic factors, infections, and immune dysfunction [69,70]. Currently, RA is managed clinically with non-steroidal anti-inflammatory drugs (NSAIDs), anti-rheumatic drugs (DMARDs), immunosuppressive drugs, etc. [71]. During the onset and spread of RA, immune T and B lymphocytes activate the effector cells and then release pro-inflammatory mediators such as IL-1, IL-6, IL-17, and TNF-α, which are primarily responsible for synovial joint inflammation and bone erosion [71]. IL-17 is an important cytokine produced by T helper 17 cells (Th17) [72]. As a potent inflammatory cytokine, it could induce the production of a variety of pro-inflammatory factors such as IL-6, TNF-α, and IL-1β, all of which can lead to an inflammatory response in tissues and cells [73] and a significant increase in IL-17 in both the serum and joint fluid of RA patients relative to osteoarthritis [74]. The production of a range of chemokines induced by IL-17 led to the recruitment of T cells, B cells, monocytes, and neutrophils in diseased joints [75]. Matrix metalloproteinases (MMPS), nitric oxide (NO), and nuclear factor-κB (RANK)/RANK ligand (RANKL) receptor activators can be upregulated by IL-17 in both cartilage and osteoblasts, leading to damage in bone and articular cartilage and promoting the development of RA [76,77]. Therefore, inhibition of IL-17 expression might be an important target to improve RA.
4.3. Anti-Inflammatory Role of Baicalin in Obesity and Type 2 Diabetes
Obesity refers to excessive total or local fat in the body, which is a “metabolic syndrome” with indicators such as abnormal blood glucose, blood fat, blood pressure, and insulin resistance (IR) [82]. Excessive nutrient intake and lack of exercise are likely to cause obesity, which is associated with insulin resistance and an increased risk of type 2 diabetes [83]. It was established that excessive white adipose tissue (WAT) is associated with the occurrence of chronic, low-grade, and systemic inflammation [84]. NF-κB, as a major pro-inflammatory nuclear transcription factor, directly increases the expression level of pro-inflammatory cytokines and chemokines [85]. The inactive state of NF-κB is chelated with a complex of inhibitor-κB (IKB) inhibitor protein family members in the cytoplasm [85]. Upon cellular activation, IκB kinase β (IKK-β) phosphorylates IκB, leading to its ubiquitination and proteolytic degradation. This in turn releases and translocates NF-κB to the nucleus and further activates target gene transcription in the nucleus [85]. Thus, inhibition of the NF-κB signaling pathway in adipose tissue reduces the incidence of chronic, low-grade, and systemic inflammation and confers a protective mechanism against the development and progression of insulin resistance and type 2 diabetes [85].
4.4. 黄芩苷在呼吸系统相关炎症中的作用
在过去几年中,呼吸系统疾病变得更加普遍,对人类健康和安全构成重大威胁。常见的呼吸系统疾病包括哮喘、IPF和PAH[91]。哮喘被认为是由持续性气道炎症引起的可逆性气道阻塞,由空气污染物和遗传易感因素引起[92]。IPF或肺纤维化(PF)是以成纤维细胞增殖和胶原沉积在肺组织结构中为特征的,是一种由肺炎、过度吸烟和/或其他因素引起的慢性间质性肺疾病,可导致结构破坏和呼吸衰竭[93]。
4.5. 黄芩苷在炎症性肠病中的治疗作用
IBD是一种慢性免疫性疾病,其特征是反复发作腹痛、腹泻和化脓性粪便[100]。IBD主要包括克罗恩病(CD)和溃疡性结肠炎(UC)[101,102,103]。黄芩苷通过抑制氧化应激、免疫调节和抗炎特性在IBD中起保护作用[104]。为了支持这一点,发现黄芩苷通过调节肠上皮细胞中的自噬和NF-κB信号通路来影响炎症过程,从而改善细胞旁通透性[105]。与此一致,据报道,在葡聚糖硫酸钠(DSS)诱导的溃疡性结肠炎模型中,黄芩苷通过调节M1巨噬细胞向M2表型的极化来减弱炎症反应[101]。同样,黄芩苷以剂量依赖性方式下调了黄芩苷在1,2,9-三硝基苯磺酸(TNBS)诱导的UC大鼠结肠中IL-2β、TNF-α、凋亡基因Bcl-4和半胱天冬酶-6的表达[106]。黄芩苷在炎症中的治疗主要通过抑制抑制剂-κB(IKB)激酶复合物(IKK)/IKB/NF-κB信号通路介导[106]。特别是,在TNBS诱导的UC大鼠中给予黄芩苷(5-20mg/kg)下调了TNF-α和IL-6的表达,并抑制了TLR4/NF-κB信号通路,从而缓解了UC[107]。据报道,黄芩苷(30-120mg/kg)通过促进超氧化物歧化酶(SOD)、过氧化氢酶和谷胱甘肽过氧化物酶(GSH-PX)等抗氧化酶的活性,以及降低丙二醛(MDA)的含量,对TNBS诱导的UC具有治疗作用[108]。该研究进一步发现,黄芩苷(100mg/kg)可降低血清中IL-6、IL-1β和IL-17的产生,并抑制高温高湿下UC模型中SOD、GSH-PX和MDA的活化[108]。这些结果表明,黄芩苷的抗炎作用归因于抑制NF-κB和MAPK信号通路的激活。
4.6. 黄芩苷在心血管疾病中的抗炎作用
This entry is adapted from the peer-reviewed paper 10.3390/ijms24119317
This entry is offline, you can click here to edit this entry!
