Lung cancer is the leading cause of cancer-related deaths. Small cell lung cancer (SCLC) accounts for 15–25% of all lung cancers. It exhibits a rapid doubling time and a high degree of invasiveness. Additionally, overexpression of c-Kit occurs in 70% of SCLC patients.
폐암은 암 관련 사망의 주요 원인입니다. 소세포폐암(SCLC)
은 전체 폐암의 15~25%를 차지합니다. 그것은 빠른 배가 시간과 높은 수준의
침습성을 나타냅니다. 또한, c-Kit의 과발현은 SCLC 환자의 70%에서 발생합니다. 본 연구에서는 SCLC
의 잠재적 치료제인 c-Kit을 표적으로 하는 항체-약물 접합체(ADC)를 평가하였다 .
먼저, 우리는 c-Kit을 표적으로 하는 완전한 인간 항체인 4C9를 생성하고 특성화했으며,
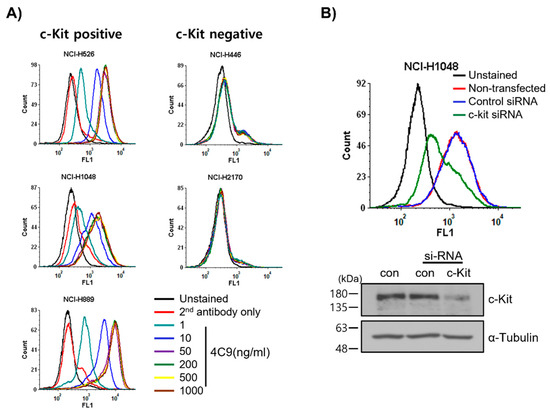
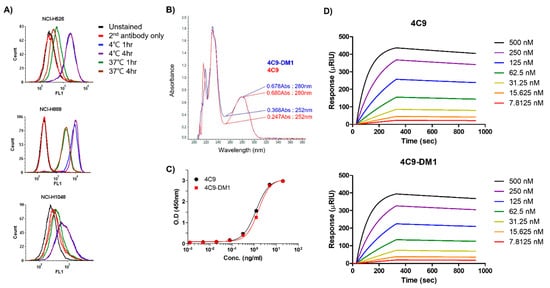
결합 친화도는 KD = 5.5 × 9 M인 c-Kit을 발현하는 SCLC 세포에 특이적으로 결합합니다.
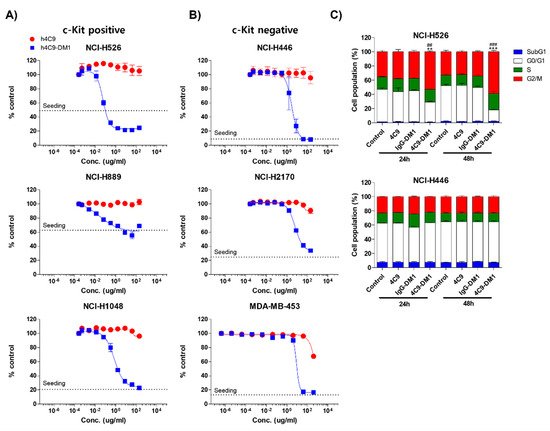
그런 다음, DM1을 사용하여 ADC를 개발했습니다. 페이로드로서의 미세소관 억제제. 4C9-DM1 효율적으로
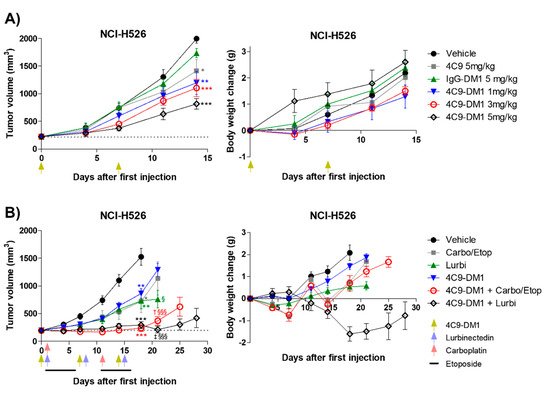
158 pM에서 4 nM 범위의 IC50으로 SCLC에서 세포자멸사를 유도했습니다. 이종이식 마우스 모델 을 사용한 생체내 분석 은 4C9-DM1 단독에 대해
45%(3mg/kg) 및 59%(5mg/kg)의 종양 성장 억제(TGI) 비율 을 나타냈습니다.
4C9-DM1 + 카르보플라틴/에토 포시드
또는 루르비넥티드의 조합 치료는 비히클 대조군과 비교하여 90% 초과의 TGI 비율을 초래했습니다. 종합
하면, 이러한 결과는 4C9-DM1이 SCLC 치료를 위한 잠재적 치료제임을 나타냅니다.
- c-Kit
- small cell lung cancer
- monoclonal antibody
- antibody-drug conjugate
1. Introduction1. 소개
2. 4C9 Antibody Specifically Binds to c-Kit2. 4C9 항체는 c-Kit에 특이적으로 결합합니다.
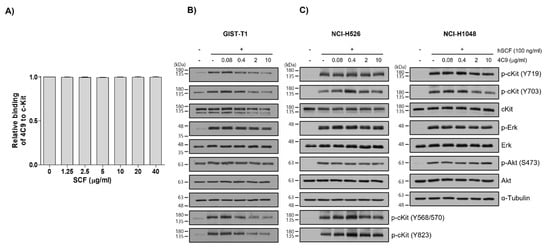
3. Generation and Characterization of ADC (4C9-DM1)3. ADC 생성 및 특성화(4C9-DM1)
4. 4C9-DM1 Exhibits Antitumor Activity In Vitro and In Vivo4. 4C9-DM1은 시험관내 및 생체내에서 항종양 활성을 나타낸다
| c-Kit Expression | c-키트 표현 | Tissue Type | 조직 유형 | Cell Line | 세포주 | 4C9-DM1 * | SMCC-DM1 |
|---|---|---|---|---|---|---|---|
| c-Kit positive | c-키트 양성 | SCLC | NCI-H526 | 0.158 | 12.23 | ||
| NCI-H889 | 0.323 | 11.62 | |||||
| NCI-H1048 | 4.08 | 30.45 | |||||
| c-Kit negative | c-키트 네거티브 | SCLC | NCI-H446 | 16.58 | 6.97 | ||
| NCI-H2170 | 35.5 | 20.17 | |||||
| Breast cancer | 유방암 | MDA-MB-453 | 47.63 | 9.763 |