Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Plant Sciences
重金属胁迫(HMS)是破坏性最强的非生物胁迫之一,严重影响植物的生长发育。一般来说,植物对 HMS 的反应涉及三个核心信号;这些是丝裂原活化蛋白激酶 (MAPK)、钙和激素(脱落酸)信号。除了这些信号成分外,其他调节因子,如微 RNA 和膜蛋白,也在调节植物 HMS 反应中发挥重要作用。
- specific transmembrane proteins
- protein-lipid interactions
- plant metal homeostasis
- Heavy metal stress
一、介绍
重金属胁迫 (HMS) 对植物的生长和繁殖产生负面影响,因此,它会导致植物中必需的农艺和其他农业生态特性的丧失 [ 1 ]。因此,农作物的产量和质量受到严重影响,而重金属(HMs)过度积累的食物是人类健康和自然生态系统的主要威胁之一[ 2 ]。植物具有特定的应对 HMS 的机制,它们进化出离子传感、信号转导、分离解毒等一系列策略,以确保在一定 HMS 水平下,它们的最佳生存和繁殖 [ 3 , 4 , 5 ]]。最近,随着几种功能性膜蛋白基因簇在调节细胞内金属稳态中发挥重要作用 [ 6 , 7 , 8 , 9 ] ,在理解植物应激反应方面取得了一些进展,尤其是下游途径。然而,这些复杂的网络级联需要在植物中的金属稳态调节机制方面进行研究。
最近的研究表明,植物生长阶段,从幼苗到成熟,决定了植物金属稳态机制和耐受性的形成。当然,植物生殖成熟期果实中的重金属含量受金属稳态影响显着,但重金属在不同植物生长阶段的系统积累途径和功能级联关系尚不清楚[ 10 , 11 ]。因此,探索HMs在植物细胞中的稳态机制具有重要意义。目前,一些研究表明,植物可以通过提高各种蛋白质和/或化合物的合成速率来调节细胞内金属离子的平衡[ 12 , 13 ,14 , 15 ]。这涉及植物对 HMS 的分子响应信号以及一些膜蛋白的调控和转录。在植物细胞中,这些金属会导致活性氧 (ROS) 的产生,从而触发各种信号转导途径的激活 [ 16 ]。HMS 中涉及的关键信号成分是丝裂原活化蛋白激酶 (MAPK)、钙和激素信号。MAPK 信号具有一些重要的成分和类型,例如 MAP 激酶激酶 (MAPKK) 和丝裂原活化蛋白激酶激酶 (MAPKS) [ 17 , 18 ]。钙信号通路使用多种钙敏感蛋白来检测 Ca 2+例如钙调蛋白 (CaM)、钙调蛋白样蛋白 (CML)、钙调神经磷酸酶样蛋白 (CBL) 和钙依赖性蛋白激酶 (CDPK)。它们沿电路激活和路由不同的信号通路 [ 19 ]。关于激素信号转导的作用,脱落酸(ABA)[ 20 ]、茉莉酸(JA)[ 21 ]和柠檬酸(CA)[ 22 ]在植物的金属耐受性中起重要作用。除了信号成分外,其他调控因子,如 miRNA 和不同类型的跨膜转运蛋白,也在植物 HMS 的调控中发挥重要作用 [ 23 , 24 ]。特定的膜蛋白可以结合不同类型的金属离子作为底物 [ 25, 26 ],从而使它们能够跨细胞膜进行离子运输,这是由膜蛋白、离子和脂质类型和内容之间的相互作用调节的。一些脂质与膜通道上的特定位点结合,从而调节植物细胞内外金属离子的转运。
2. HMS下膜蛋白与脂质的相互作用
所有的膜,主要由脂质和蛋白质组成,都是高度动态的,会经历各种各样的相互作用 [ 135]。这些相互作用的复杂性会导致膜蛋白结构和功能的多样化。因此,在HMS下,膜蛋白可以促进细胞间通讯,从而调节细胞内外的稳态以及通过植物细胞中的能量传输和信号转导对金属离子进行解毒。随着脂质组学和膜蛋白结构分析的深入,脂质结合膜蛋白的具体位点和功能得以可视化和研究。例如,最近最先进的分析方法的应用,如 X 射线晶体学、核磁共振 (NMR) [ 136 ]、电子顺磁共振 (EPR) [ 137] 和天然质谱 (MS) 结合分子动力学 (MD) [ 138 ] 现在使我们能够进一步研究维持膜蛋白结构和功能的脂质的特性。因此,这些方法可能为深入了解脂质和膜蛋白之间相互作用的过程及其在植物 HMS 耐受性中的作用提供新的机会。
2.1. 膜蛋白和脂质重塑
HMS可以引起植物内膜的重组,其中脂膜蛋白结合的重新分布在很大程度上与金属稳态的调节密切相关[ 139 ]。由于膜蛋白在脂质双层中的位置,膜蛋白的结构和功能可能与其在脂质中的位置有关[ 140 ]。不同类型的膜蛋白发挥不同的作用,可以以不同的方式调节离子稳态。有趣的是,膜蛋白可以非特异性结合多种脂质,通常用作蛋白质吸附溶剂(环状脂质),而其他少量脂质可以作为辅因子(非环状脂质)特异性结合膜蛋白,完成改造过程【141 ]。特定的脂质就像纽扣,而膜蛋白就像衣服,因此这些脂质将膜蛋白精确地固定在正确的位置。同时,溶剂脂质,也称为环状脂质,可以在膜蛋白周围形成稳定的环状脂质壳,并可以进一步固定膜蛋白[ 142 ]。因此,它们可以共同定义膜蛋白的位置,保证膜骨架的稳定性。此外,这些脂质还可以通过构型变化与膜蛋白相互作用,从而调节植物对 HMS 的耐受性。
在内膜重组过程中,微生物中也报道了少量的脂膜蛋白相互作用(图1),其类型与其结构和底物有关。一个共同的特点是它们的位置和功能取决于膜环境的复杂性。作为辅助因子,脂质(无环脂质)通常结合在膜蛋白的跨膜螺旋之间,在膜蛋白内和/或在多亚基蛋白界面(图1A-D)。然而,在 HMS 下,大量金属离子是游离的,这可能导致这些位点的取代和/或失活,这取决于它们的电荷强度 [ 143 , 144 ] 和这些脂质的头基[ 143 , 144 ]。145 ]。这些条件可能会触发一系列膜蛋白应激反应和信号,这可能导致膜蛋白跨膜结构域的改变 [ 146 ]。
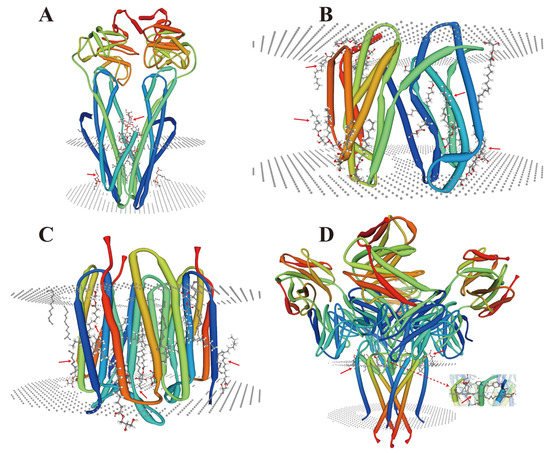
图 1.脂膜蛋白相互作用的晶体结构分析。( A )大肠杆菌( E.coli ) MsbA 与 LPS 和抑制剂 G907 复合物(PDB ID:4KSC)[ 147 ];( B ) 脂质 II 翻转酶 MurJ,非洲热虹吸菌的外向构象(PDB ID:6NC9)[ 148 ];( C )盐酸盐中细菌视紫红质的稳态-SMX暗态结构(PDB ID:6RQP)[ 149 ];( D ) KcsA-G77A 突变体的结构或Streptomyces lividans 中K(+) 通道选择性过滤器的 2,4-离子结合配置(PDB ID:6NFU)[ 150 ]。PDB,蛋白质数据库;MsbA,革兰氏阴性菌中必不可少的 ATP 结合盒转运蛋白;LPS,脂多糖;MurJ,大肠杆菌中的脂质 II 翻转酶。红色箭头表示脂质和膜蛋白相互作用的位置。
根据膜蛋白与脂质之间的亲和力,在内膜重塑中起关键作用的脂质可分为块状脂质、环状脂质和非环状脂质。大量脂质(不与膜蛋白直接接触)在双层中迅速膨胀。同时,环状脂质通过疏水性与膜蛋白结合形成稳定的复合物,并操纵膜蛋白发挥功能并进行物质交换,这取决于膜的疏水性和脂膜蛋白结合表面的电荷分布. 特别是,非环状脂质在调节膜蛋白方面具有多种功能,因为它们的不同构型可以与膜蛋白结合形成非常稳定的结构。研究发现,即使在蛋白质被洗涤后,它们仍然结合在一起,纯化和/或结晶。这种稳定的结构可能在植物的 HMS 中发挥重要作用。例如,非环状脂质作为辅助因子阻断离子传导并调节膜蛋白的活性。
2.2. 脂质与膜蛋白的金属配位
近年来,膜蛋白的结构分析取得了很大进展。然而,复杂细胞环境中脂质蛋白和膜蛋白之间的相互作用仍未得到充分研究。最近出现的 X 射线自由电子激光 (XFEL) 飞秒晶体学为探索难以捉摸的膜蛋白及其复合物提供了一个创新机会 [ 151 ]。当与其他技术结合使用时,例如电子顺磁共振 (EPR)、分子动力学 (MD)、原子力显微镜 (AFM) [ 152 ] 和荧光共振能量转移 (FRET) [ 153],与膜蛋白直接相互作用的金属离子和脂质,以及相互作用位点,甚至共价键,也可以被分析和研究。仪器和技术的进步为研究脂质-蛋白质复合物的合成提供了前所未有的机会。目前,膜蛋白复合物的晶体结构大多与非环状脂质一起报道[ 138 ]。已经表明,脂质可以通过减少氘吸收来保护膜蛋白,同时可以研究受脂质结合保护的位点 [ 154 , 155 ]。一些膜蛋白仅在特定类型的脂质存在时才表现出金属配位活性(图 2)。这些蛋白质复合物可以被纯化,并且它们的晶体结构可以机械地可视化。大多数这些脂质是非环状脂质。然而,对植物中这些类型的蛋白质-脂质相互作用的研究非常有限。预计未来的研究可以依托现有的先进技术,联合起来更广泛地分析蛋白质复合物的结构,从而为理解HMS下复杂细胞环境中膜脂的作用机制提供可能。
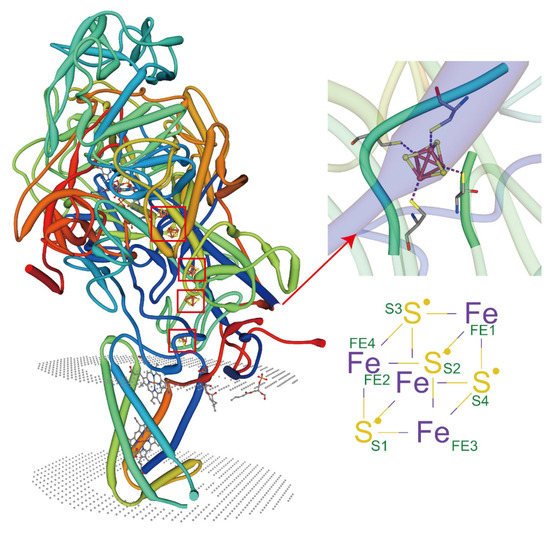
图 2.脂质调节金属离子与膜蛋白的配位。PDB ID:3IR5,X 射线衍射,2.30 Å。大肠杆菌中NarGHI 突变体 NarG-H49C 的晶体结构。跨膜螺旋之间存在紧密结合的脂质,而头部基团结合在由三个亚基组成的口袋中,许多带正电荷的残基参与结合。
2.3. 作为脂质传感器的特殊离子通道
离子通道是一种促进各种化学物质通过膜的膜蛋白。由于多种因素,例如跨膜电位 [ 156 ]、复合刺激 [ 157 ] 和膜收缩力,通道会打开或关闭。在这些因素的影响下,通道经历了从封闭状态到开放状态的结构变化,从而使衬底沿电化学梯度运动。自从发现细胞膜选择性渗透钠离子、钾离子和氯离子以来,通道已被广泛研究。可兴奋细胞的离子通道响应突触刺激并通过建立静息膜电位传递动作电位 [ 158]]。近年来,研究人员对膜通道的结构和功能进行了大量工作,特别是将它们用作生物传感器来监测新分子的发展和应用,以研究它们在不同细胞功能中的作用和活动 [ 159]、160、161、162、163 ]。根据感知外部刺激的方法,离子通道分为三类:(A)电压门控通道,(B)配体门控通道和(C)机械敏感通道。它们以不同的方式对脂质作出反应(图 3)。
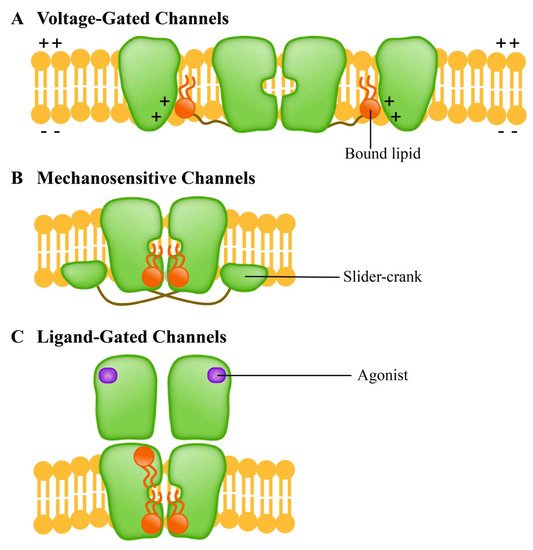
图 3.不同的离子通道蛋白家族具有不同的脂质反应模式。( A )电压门控通道(电压门控通道)是四聚体;( B ) Mechanosensitive channels(机械敏感通道)使用“曲柄滑块”机构将增加的双层张力转换为通道门控;( C ) 配体门控通道 (ligand gated channel) 影响 TM 螺旋堆叠的功能以改变通道功能。
电压门控通道介导 K +、Na +、Ca 2+和 Cl -的跨膜运动,以响应膜电位的变化 [ 86 ]。该通道包含四个同源域;每个结构域由六个跨膜螺旋 (S1-S6) 组成。S1-S4 负责电信号的感应,而 S5-S6 负责孔的形成 [ 164 ]。配体门控通道是跨膜蛋白,是真核信号级联的常见部分。植物环核苷酸门控通道 (CNGC) 是一种具有四聚体结构的阳离子通道,允许单价和二价阳离子如 Ca 2+和 K +扩散[ 165 , 166 ]。CNGC 家族有助于植物中 HM 离子的吸收和运输 [ 167 ]。机械敏感通道,通常是多聚体,是主要响应机械刺激的孔蛋白的总称。在机械力的刺激下,允许物质(主要是离子)跨膜传输,机械信号可以转化为电信号和/或化学信号[ 168 ]。植物中的机械敏感通道可能会被外部机械刺激激活,如触摸、风、盐度和重力 [ 169 , 170]。研究表明,植物中细菌机械敏感通道 (MSC) 的同源物可以通过在受膜张力控制的过程中释放小的渗透性物质来降低细胞内渗透压 [ 169 ]。
2.4. 膜蛋白在脂质流出中的作用
质膜是细胞运输的基础,通过使用脂质双层形成一个紧密的屏障,允许细胞和外部环境因素之间的物质选择性交换。膜脂质通过两种方式调节膜转运蛋白的功能:一种是与转运蛋白紧密结合并特异性结合,另一种是通过多样化的脂双层调节转运蛋白的功能[ 170 , 171 ]。
ABC 家族的成员参与各种脂质和蛋白质-脂质复合物的转运和重新分布 [ 172 ]。ABCs 主要位于质膜中,尽管其中一些也位于细胞液(胆固醇和鞘氨醇)的微区中。这些在其他细胞器中也有报道,例如高尔基体和内质网 [ 173 , 174 ]。一般来说,载脂蛋白和白蛋白是大多数鞘脂的受体,鞘脂是动物 ABC 转运蛋白的底物(图 3)。尽管对植物这方面的研究有限,但未来的研究有望填补这一空白。
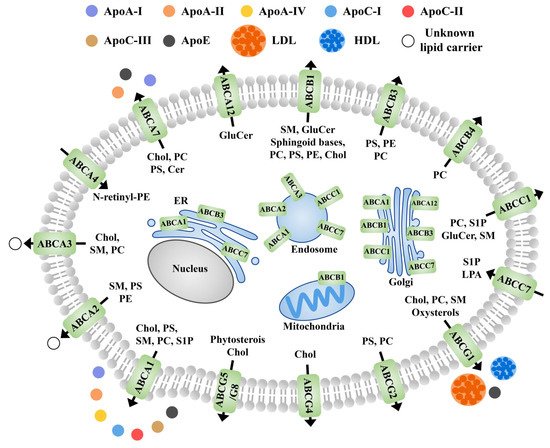
图 3. ABC 转运蛋白参与动物脂质流出的亚细胞定位、已知受体和转运方向示意图。黑色箭头表示跨质膜的运输方向。载脂蛋白,载脂蛋白;PS,磷脂酰丝氨酸;PC,磷脂酰胆碱;PE,磷脂酰乙醇胺;胆固醇,胆固醇;HDL,高密度脂蛋白;低密度脂蛋白,低密度脂蛋白;GluCer,葡萄糖神经酰胺;Cer,神经酰胺;SM,鞘磷脂;N-伦丁基磷脂酰乙醇胺;LPA,溶血磷脂酸;S1P,1-磷酸鞘氨醇;N-视黄基-PE。
2.5. 协同参与金属离子特异性结合
植物膜主要由磷脂组成,并包含一系列令人眼花缭乱的复杂成分,如鞘磷脂、甾醇、糖基化连接的碳水化合物和膜蛋白 [ 175 ]。细胞与其外部环境的分离不能仅靠脂质屏障来维持。在有机体和细胞暴露于 HMs 的情况下,膜蛋白会主动调整脂质屏障两侧的不同条件 [ 176 ]。膜蛋白可能穿过磷脂双分子层和/或与脂质的极性头相互作用,从而直接或间接地影响细胞膜的结构甚至膜的组成 [ 177 , 178 ]]。值得注意的是,膜蛋白还需要允许通过细胞膜的结构屏障发生受控信号(图 4)。膜蛋白的结构和功能受脂质以及蛋白质与特定脂质之间的相互作用的影响 [ 179 ]。
图 4.蛋白质以不同方式与脂质结合。(A) 外周蛋白与具有脂质特异性的疏水锚定 PS 栓剂结合。(B) 参与信号感知和跨细胞膜传输的整联蛋白受体。(C) 诱导囊泡融合的蛋白质。(D) 具有由疏水性错配引起的局部曲率的整联蛋白。(E) 外周蛋白附着在膜脂上,它们的球状结构域与膜界面区域相互作用,而不嵌入膜中。(F) 离子通道与胆固醇相互作用以控制离子跨膜转运。(G) 磷脂扰乱酶通过膜运输脂质。
3. 基于新型金属组学数据库的膜蛋白-金属结合域和相互作用分析
微量金属是无机元素;所有生物体的生长、发育和其他细胞功能都需要它们。细胞需要金属离子作为辅助因子来组装和激活金属蛋白。大多数金属直接与膜蛋白上的特定位点结合,而少数金属必须形成含金属的辅因子或复合物才能插入目标蛋白 [ 226 ]。金属蛋白是细胞蛋白质组中数量多、种类多的蛋白质类型。它们不仅催化一系列重要的生化反应,而且还展示了独特的结构和调节功能 [ 227]。据推测,大约三分之一的蛋白质必须与金属结合才能发挥生物学功能,而几乎一半的酶必须与一种或多种金属离子结合才能发挥作用。该家族中金属蛋白的数量取决于它们在细胞中结合的金属的数量和类型。估计有数百个锌相关蛋白家族,而镍依赖型蛋白家族的数量不到 10 个 [ 228 ]。金属蛋白的存在需要对金属代谢和体内平衡进行严格的调控,以保持细胞内适当的金属浓度,同时避免在细胞内运输、储存、解毒和排泄过程中产生毒性作用 [ 229 ]。
近年来,随着基因组测序技术的发展,基因组数据量呈指数级增长,因此迫切需要开发生物信息学算法来预测新的金属蛋白甚至寻找一整套金属蛋白。已经开发了许多计算工具和方法来预测金属蛋白基因和金属结合位点,尤其是与 Zn 和 Fe 相关的位点 [ 181 ]。
This entry is adapted from the peer-reviewed paper 10.3390/membranes11120984
This entry is offline, you can click here to edit this entry!
