Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Pharmacology & Pharmacy
菌影 (BG) 是由克隆基因 E 的受控表达产生的革兰氏阴性菌的空细菌包膜,在活细菌的包膜内形成裂解隧道结构。在全球范围内,BG 已被用作疫苗递送系统和疫苗佐剂。人们对开发基于 BG 用于生物医学应用的新型递送系统越来越感兴趣。
- bacterial ghosts
- gene E
- vaccines
- immune
一、介绍
药物、核酸和其他生物分子的递送系统是生物技术的最新发展 [ 1 , 2 ]。人们对新型靶向递送系统的设计和开发越来越感兴趣。细菌衍生物,包括细菌幽灵 (BG)、细胞外囊泡和食物毒素,是流行的生物纳米材料,是潜在的疫苗和药物载体 [ 3]]。这些递送平台保留了细菌的许多优点,包括定植和靶向人体组织的能力、增强疫苗的免疫原性以及具有良好的装载能力。基因工程和化学生物技术的进步促进了不同类型 BG 的发展,这将在固定化酶技术、农业和医学中发挥重要作用 [ 4 ]。最近,BG 作为靶向递送生物分子的潜在候选者受到越来越多的关注 [ 5 , 6 ]。
本质上,BG 是带有孔的细菌外壳。基因工程或化学方法可用于诱导细胞内容物的释放;因此,它们没有核酸、核糖体或其他成分 [ 7 ]。因此,大多数 BG 上表面抗原的结构完整性保持完整 [ 8 ]。使用甲醛和热处理等方法制备灭活疫苗会破坏细菌的表面结构 [ 9 , 10 ]。相反,通过基因工程制备的 BGs 保留了病原菌表达的所有结构抗原,可诱导非常强、有效的体液和细胞免疫反应 [ 11 ]。BGs的结构如图1所示. 它们包含病原体相关分子模式 (PAMP),例如脂多糖 (LPS)、脂蛋白 (LPP)、肽聚糖 (PGN) 和菌毛等,它们是细菌外壁高度保守的结构 [ 12 ]。一旦进入宿主,BG 就会被免疫细胞上的模式识别受体 (PRR) 识别,刺激多种免疫介质的产生,从而诱导抗原呈递细胞 (APC) 的成熟,例如树突细胞 (DC) [ 13 , 14] ]。一般而言,致病菌鬼血清型保存良好,高浓度的BG可提供较高的免疫原性。此外,它们只能通过洗涤、离心和冷冻干燥来纯化 [ 15]。基于这些新的生物学特性,BG 是潜在的疫苗递送系统 [ 16 ]。它们已逐渐被用于递送核酸、蛋白质和化学药物 [ 17 ]。
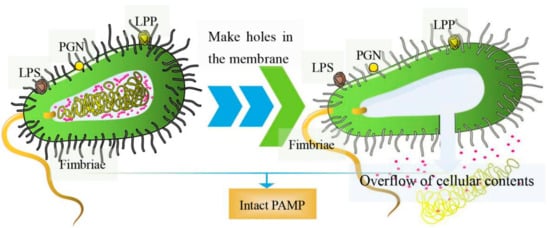
图 1. BG 示意图。(左)细菌表面形成孔隙;(右)细胞内容物的溢出,包括核酸、核糖体和其他成分。
2. BGs 制备方法
2.1. 基因工程
ΦX174 是一种单链 DNA 噬菌体,当感染革兰氏阴性菌时,它会抑制细菌膜上的磷酸-MurNAc-五肽转位酶 (MraY) 的活性。这是由裂解蛋白 E 介导的,这是一种疏水蛋白,可抑制细菌细胞壁中 PGN 的合成 [ 19 ]。首先,疏水性 N 端结合细菌细胞壁的内膜。然后,蛋白质 E 的构象发生变化,将其疏水性 C 末端穿过内部和周质空间与细胞壁的外膜结合 [ 20 ]。这种破坏会导致二次效应,例如磷酸酶活性的激活和膜迁移率的增加。这会增加内部渗透压,诱导细胞内容物的释放 [ 21]。目前,制备BG最常用的方法是将裂解基因E(276 bp,登录号:MF426914.1)克隆到革兰氏阴性菌的表达调控系统中,利用控制元件的开关功能来控制表达[ 22 ]。BGs的制备过程如图2所示。
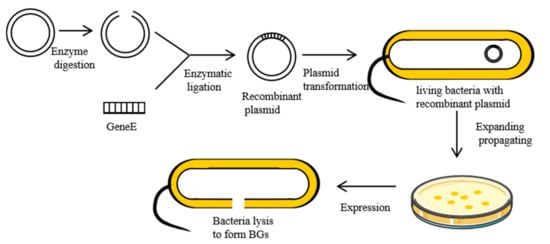
图 2.使用基因工程制备 BG。
构建的 BG 长约 1-2 μm,宽约 0.5-2 μm。裂解蛋白 E 连接内膜和外膜,最大限度地减少周质空间中酶的损失。在细菌裂解过程中,内外膜结构保持完整。跨膜孔的直径约为 40-200 nm,但在渗透压下,它们可以达到 500 nm [ 23 ]。孔径由细胞壁中 PGN 层的筛孔尺寸决定 [ 24 ]。
跨膜隧道是在细菌分裂位点或细菌极帽处形成的,但主要在细菌位点,这与细菌分裂过程中的Z环形成机制有关。细菌分裂蛋白 FtsZ 是 Z 环形成所必需的 [ 25 ]。维特,A. 等。发现蛋白质 E 介导的裂解发生在 FtsZ 的 GTPase 活性存在下,这与 Z 环结构无关 [ 26 ]。然而,由 FtsZ 的 GTPase 活性引起的蛋白质 E 构象变化的机制应进一步研究。
温度敏感性λ pL/pR-cI857 的表达或化学诱导的表达系统(基于Lac 启动子的各种杂种的高效表达系统)通常用作选择成功转化的标记[ 23 ]。对于λPL / PR-子cI857表达,在适当温度下,细菌培养至对数生长期,将温度升高至42之前℃,以诱导基因E [的表达式27,28,29 ]。对于化学诱导表达系统,将IPTG或阿拉伯糖添加到原始培养基中以获得BGs [ 21 ]。获得的BGs被冻干。冻干的 BGs 可以在室温下储存多年 [ 30]。巴里萨尼·阿森鲍尔等人。在发酵罐中培养大肠杆菌直到 OD600 = 0.9,大约需要 90 分钟。在温度敏感的表达系统下,42°C 的温度会诱导蛋白 E 的表达。表达 120 分钟后,裂解效率达到 99.9% [ 31 ]。兰格曼等人。通过将细菌的混合培养基加热至 42°C 来制备 BG。2 小时后,细菌裂解效率达到 99.99% [ 21]。即使有很好的裂解,残留的病原菌也有潜在的危害。因此,需要二次灭活以实现完全裂解。由于紫外线辐射或甲醛灭活会破坏 BG 表面抗原的结构,常用的方法包括添加 β-丙酮 (BPL) 进行灭活、冷冻干燥并在 -20 °C 下储存 [ 10 , 32 ]。庆大霉素和链霉素也用于灭活未裂解的细菌 [ 33 ]。双基因失活也已用于二次失活。朱等人。通过将葡萄球菌核酸酶 A (SNUC) 基因整合到表达 E 融合基因的裂解质粒 (mE-L-SNA) 中,提高了细菌的裂解效率。大肠杆菌的裂解效率在对数生长期达到99.99995%,从而提高了BGs的安全性[ 34 ]。田等人。构造链球菌鸡白痢通过诱导的裂解后熔断抗微生物肽基因,SMAP29,用裂解基因E.二十四小时鬼,他们没有发现任何活细菌[ 35 ]。耶姆等人。构建大肠杆菌突变株(MC4100) 通过删除 ASD 基因,该基因编码参与二氨基庚二酸 (DAP) 合成的天冬氨酸半醛脱氢酶。突变菌株的生长完全取决于添加到培养基中的 DAP 量。基因 E 被诱导后,将目标细菌/BG 在不含 DAP 的 LB 培养基中培养 12 小时,离心、收集并冷冻干燥以完全灭活大肠杆菌[ 36 ]。化学和基因工程方法可以灭活残留的病原菌。
目前,基因 E 裂解系统的表达调控已成功应用于多种革兰氏阴性菌,鼠伤寒沙门氏菌[ 37 ]、肠炎沙门氏菌[ 8 ]、霍乱弧菌[ 38 ]、Pectobacterium cypripedii [ 39 ]、幽门螺杆菌[ 40 ]、胸膜肺炎放线杆菌[ 41 ]、流感嗜血杆菌[ 42 ]、多杀巴氏杆菌[ 43 ]、布鲁氏菌[ 44 ]] 和嗜水气单胞菌[ 45 ] 等。鉴于细菌种类繁多,这些发现意味着任何合适的基因 E 载体,也许所有革兰氏阴性细菌,都可以产生基于裂解的 BG。然而,BG 的制备方法面临着一些挑战。(I) 质粒并非适用于所有革兰氏阴性菌,应针对每个菌株进行研究和修饰。细菌分裂过程中质粒分布不均导致质粒丢失;因此,需要确定基因E是否可以克隆到细菌基因组中。(II) 在制备BGs的过程中,抗生素抗性基因与裂解基因E一起被引入。抗生素抗性基因可以在环境中横向转移[ 46]]。(III) 有许多裂解抗性突变体,尤其是大肠杆菌。大肠杆菌,需要双基因灭活,如结合基因E和基因SNUC[ 47 ]。
2.2. 化学方法
“海绵状”方法是制备 BG 的常见化学过程。在这种方法中,使用化学试剂通过细菌细胞壁形成孔。然后,通过离心去除细胞内容物(图 3A)。阿马拉等人。使用低于最低抑菌浓度 (MIC) 的化学品,如 NaOH、SDS、H 2 O 2和 CaCO 3来制备 BG。然后,他们使用 Plackett-Burman 实验设计来优化“海绵状”大肠杆菌幽灵的制备条件[ 50 ]。舍维塔等人。通过在 NaOH、Na 2 CO 3的混合物中培养鲍曼不动杆菌 Ali190制备“海绵”BG和 H 2 O 2 [ 11 ]的溶液。在这些方法下,细胞壁完整性保持完整。萨梅等人。设计了一种新的化学方法,通过在补充有 7% 吐温 80 的培养基中培养沙门氏菌24 小时来制备 BGs [ 51 ]。使用乳酸将培养基的 pH 值降至 3.6。吐温 80 使细菌外膜中的疏水成分溶解,从而形成薄弱区域。这些区域促进了由 pH 值突然降低引起的穿孔形成。在另一种生化方法中,BGs 是通过在溶解在 Na 2 HPO 4溶液中的人工合成模型两亲肽 (MAP) 中培养细菌来开发的。图 3 B) [ 52 , 53 ]。化学过程可以在细菌生长的任何阶段进行,只需稀释以控制 OD 600 = 0.1。基因E介导的裂解效率在对数生长期最好,稳定期裂解导致活细菌存活[ 54 ]。此外,化学方法不限于革兰氏阴性菌,因为它对革兰氏阳性菌和酵母菌也有效[ 55 ]。
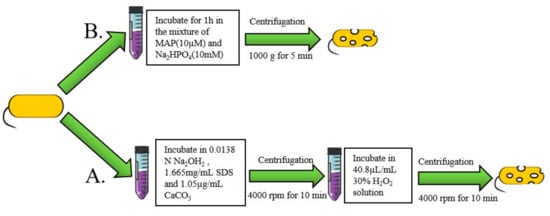
图 3. BGs 的化学制备方法。( A ) 使用模型两亲性肽 (MAP) 制备 BG。( B ) 制备 BG 的两步法。
使用化学试剂快速制备 BG 消除了与使用裂解基因 E 相关的限制,特别是基因限制修饰 [ 2 ]。化学方法简单、快速,除产生孔洞外,不改变细胞三维形态。然而,化学品可能会使表面免疫原性抗原变性。过多的孔可能会破坏控释特性。应进行后续实验以解决这些挑战。因此,基因工程方法仍然是应用最广泛的技术。
3. 基于 BG 的疫苗
3.1. DNA疫苗
裸 DNA 疫苗受到其弱免疫原性的限制。为了引起更强的免疫反应,它们通常与各种佐剂,如明矾结合。然而,目前使用的佐剂有各种限制,任何重组疫苗制造商可用的佐剂选择都非常有限。然而,载体转运可以增强其免疫原性和效率[ 90 ]。目前常用的核酸载体包括病毒(流感病毒、腺病毒、脊髓灰质炎病毒等)、真菌(酵母菌)、细菌(卡介苗)等。作为载体,植物园可通过各种细胞,例如小鼠巨噬细胞内化的RAW 264.7,HCDECs,DCS和的Caco-2 [ 76,86,91 ]。体外细胞实验表明,60% 的巨噬细胞(原始 264.7)可以内化含有报告质粒的 BG,然后表达绿色荧光蛋白 [ 92 ]。DC 还可以内化 BG 并分泌 IL-12 以激活 Th1 免疫反应 [ 93 ]。APC 细胞对 BG 的内化和激活为疫苗接种和原位免疫治疗提供了一种新策略。携带质粒的BGs采用扩散策略(质粒DNA通过裂解孔扩散到BGs中)[ 92 ],核酸可以与BGs非特异性结合(带负电荷的DNA与内膜中带正电荷的基团结合,如胺类) )。每个 BG 可以加载 4000–5000 个质粒 DNA 拷贝(从中型到大型质粒)[ 94]。这些体外实验已经证明BGs对于核酸递送是可行的。在小鼠模型中,已经有很多基于BG的核酸疫苗的研究。周等人。使用 BG 作为传递系统来制备有效的 DNA 疫苗以预防鹦鹉热感染 [ 79 ]。这种基于 BG 的 DNA 疫苗比裸 DNA 疫苗和 BG 诱导更强的体液免疫(IgG 上调)和细胞免疫(Th1 型免疫相关指标上调)。焦等人。所使用的小号almonella鬼以制备DNA疫苗以预防淋病奈瑟菌[ 80]。他们发现,相对于裸 DNA 疫苗和单独的 BG,基于 BG 的 DNA 疫苗诱导更强的体液免疫(IgG 上调)和淋巴细胞增殖。在骨髓衍生 DCs (BMDCs) 的模型实验中,Jiao 等人。用 BMDCs 培养疫苗 [ 95 ]。他们发现基于 BG 的 DNA 疫苗比裸 DNA 疫苗和单独的 BG 促进了更大的 DC 成熟和激活(细胞表面共刺激分子 CD80、CD86、CD40 和 MHC-II 的上调)。这些结果表明,与裸 DNA 疫苗相比,用负载 BG 的质粒制备的 DNA 疫苗对体液和细胞免疫具有更好的刺激作用。曹等人。使用过的DH5α装载含有五个外源片段(包括不变链状蛋白[Iclp]基因)的质粒的ghosts,制备用于草鱼口服免疫的双靶向DNA疫苗[ 81 ]。带有内源性 Iclp 的质粒很容易进入 MHC-II 抗原呈递途径。双靶向 DNA 疫苗的免疫显着增加了血清和肠粘液中三种先天免疫参数(SOD、LZM 和 C3)的活性。而且,实验组的相对存活率达到了81.11%,证明了疫苗对弧菌的有效性。菌株。这些研究表明,BGs 中的抗原基因可以被 APCs 内化和表达,外源基因可以来自多个质粒或含有融合基因片段的质粒。多基因 BGs 疫苗比裸 DNA 疫苗诱导更强的免疫反应。
3.2. 蛋白抗原疫苗
BGs 以两种方式作为蛋白质疫苗的载体。(I)多表位肽BGs:通过基因工程,将抗原和蛋白靶点展示在表面,提高其免疫原性和靶向性。(II) 非重组BGs混合物:当抗原与BGs共孵育时,蛋白质非特异性结合内膜。然而,为了获得强大的免疫反应,应进一步研究蛋白质和 BG 的最佳剂量。Tuntufye HN 等。发现基于 BG 的铁-铁载体受体重组疫苗可以保护鸡免受禽类致病性大肠杆菌APEC 感染 [ 83]]。他们发现重组BGs疫苗和非重组混合疫苗均可显着提高IgG免疫反应并降低感染后死亡率。此外,与非重组混合疫苗相比,重组BGs 鸡的死亡率较低。赛工等。通过在大肠杆菌O157: H7 的外膜蛋白 A (OMPA) 中表达肠病毒71和柯萨奇病毒的抗原蛋白,开发了一种针对手足口病的疫苗[ 15 ]。该疫苗增加了 IgG 和 IgA 的分泌,从而诱导了粘膜免疫。此外,候选疫苗可以保护小鼠免受大肠杆菌的侵害感染。除了在 BGs 的外膜上表达蛋白质抗原外,Riedmann 等人。通过将流感嗜血杆菌(NTHi) 抗原 (OMP26) 融合到大肠杆菌的 S 层或周质空间中,通过肠道或肺部接种 BG 增强细胞免疫反应[ 42 ]。总之,BGs上的内膜蛋白、周质间隙蛋白和外膜蛋白具有抗原性,可以诱导免疫原性。与蛋白质亚单位疫苗相比,BGs 佐剂显着增强了抗原蛋白质的免疫原性 [ 20 ]。
目前,如何提高BGs的蛋白质负载能力越来越受到关注(图4)。为了实现这一点,已经尝试在 BG 的内膜中表达链霉亲和素,而目标蛋白是用生物素邻苯二甲酸化的。生物素和链霉亲和素之间的特异性相互作用将靶蛋白固定在内膜中。在其他研究中,蛋白质通过基因工程附着在细菌膜上。例如,Sührer 等人。将半乳糖苷酶锚定在含有细胞色素 b5 的 BG 上以固定酶 [ 96 ]。在其他研究中,BG 已通过与膜囊泡融合来密封 [ 97 ]。
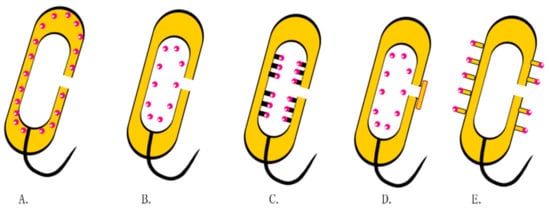
图 4. BG 中的载药策略。( A ) 通过基因工程在周质空间表达蛋白质或抗原。( B ) 药物与内膜的非特异性结合。( C ) 使用链霉亲和素将外源蛋白质或抗原附着在内膜上。( D ) BGs 被膜囊泡包裹。( E ) 多表位肽 BG。
BGs 可以与感兴趣的抗原混合,或者抗原可以在革兰氏阴性细菌中表达以转化为 BGs,从而创建具有整合抗原的细菌外壳。鉴于 COVID-19 核酸疫苗的成功,基于 BG 的疫苗研究应充分利用 BG 在其候选疫苗中的天然内在佐剂作用。
This entry is adapted from the peer-reviewed paper 10.3390/pharmaceutics13111892
This entry is offline, you can click here to edit this entry!
