Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Immunology
La muerte celular programada 1 (PD-1) y sus ligandos PD-L1 y PD-L2 son receptores que actúan en respuestas inmunitarias coestimuladoras y coinhibidoras. La señalización de la vía PD-1 / PD-L1 o PD-L2 es esencial para regular las respuestas inflamatorias a infecciones, autoinmunidad y alergias, y se ha estudiado ampliamente en el cáncer.
- PD-1
- PD-L1
- PD-L2
- asthma
- BTLA
1. Introducción [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] [ 8 ] [ 9 ] [ 10 ] [ 11 ] [ 10 ] [ 12 ] [ 13 ] [ 10 ] [ 14 ] [ 15 ] [ 16 ] [ 17 ] [18 ] [ 19 ] [ 20 ] [ 21 ] [ 22 ] [ 23 ] [ 10 ] [ 24 ] [ 25 ] [ 26 ] [ 27 ] [ 28 ] [ 29 ] [ 30 ] [ 31 ] [ 32 ] [ 33 ] [ 34 ] [ 35 ] [ 36 ] [37 ] [ 38 ] [ 39 ] [ 40 ] [ 41 ] [ 42 ] [ 43 ] [ 44 ] [ 45 ] [ 46 ] [ 47 ] [ 4 ] [ 4 ] [ 10 ] [10 ] [ 25 ] [ 4 ] [ 4 ] [ 48 ] [ 10 ] [ 10 ] [ 4 ] [ 10 ] [ 25 ]
Las enfermedades alérgicas se caracterizan por respuestas inmunes hiperreactivas a antígenos que de otro modo se encuentran inocuos en la población general, cuya incidencia y prevalencia están aumentando en todo el mundo, particularmente en el mundo desarrollado. En algunos países occidentales, uno de cada tres niños necesita atención médica de un médico a causa de enfermedades alérgicas [ 1 , 2 , 3 ].
El proceso inflamatorio alérgico involucra diferentes tipos de células que liberan una variedad de mediadores inflamatorios y citocinas. Las citocinas Th2, incluidas IL-4, IL-5 e IL-13, inducen la producción de IgE, mientras que la IL-5 promueve la infiltración de eosinófilos [ 4 , 5 ]. Otros factores, incluidas las citocinas Th1, a veces pueden afectar la manifestación clínica creando una posible inducción de tolerancia o hiperactividad [ 6 ]. Además, la progresión de la enfermedad alérgica está mediada por el sistema inmunitario innato de la mucosa del tracto respiratorio o gastrointestinal.De hecho, las células presentadoras de antígenos (APC) se activan y las alarminas epiteliales (IL-25, IL-31, IL-33 y TSLP) se liberan debido a la activación de las células epiteliales de las vías respiratorias en respuesta a los alérgenos [ 7 ], que conduce a la activación de patología alérgica mediada por Th2 / mastocitos / eosinófilos / eosinófilos, incluidas IL-4 e IL-5. Otra vía es la respuesta mediada por neutrófilos / Th1 / Th17 a la activación inmunitaria innata crónica y la obstrucción irreversible de las vías respiratorias [ 8 , 9 ].Además, la alta plasticidad celular en el contexto de la inflamación impulsada por el tipo 2 se refiere a la capacidad de las subpoblaciones de células T colaboradoras para responder dependiendo de las señales ambientales que se diferencian en otros tipos de células efectoras. Por ejemplo, en el asma crónica, las citocinas Th1 y Th2 contribuyen a la remodelación de la pared de las vías respiratorias. Otro grupo de células que responden a las señales ambientales son las células linfoides innatas del grupo 2 que exhiben un fenotipo dinámico en la inflamación alérgica de las vías respiratorias [ 10]. Las enfermedades alérgicas como el asma son heterogéneas con múltiples afecciones. Los fenotipos moleculares definidos en función de la célula inflamatoria predominante son los endotipos. En este contexto, la respuesta inmune de tipo 2 se puede clasificar en diferentes subgrupos, como IL-5 alta, IL-13 alta o IgE alta, y otros [ 11 ].
Por el contrario, la IL-10 regula negativamente el proceso inflamatorio. La IL-10 actúa directamente sobre las células T CD4 +, principalmente mediante la regulación negativa de IL-2 y otras citocinas producidas por las células Th1. También inhibe la producción de IL-4 e IL-5 por parte de las células Th2. En las células dendríticas (DC), los monocitos y macrófagos y las APC, los efectos de IL-10 incluyen la inhibición de la producción de moléculas mediadoras libres en el medio, como la disminución del receptor, o la presentación de antígenos y la fagocitosis abolidas [ 12]. Por lo tanto, la IL-10 desempeña un papel esencial como molécula reguladora en las respuestas inmunitarias tanto innatas como adaptativas, lo que conduce a la tolerancia inmunitaria o la atenuación de la inflamación tisular en los seres humanos. De manera similar, la muerte celular programada 1 (PD-1) y sus ligandos PD-L1 y PD-L2 juegan un papel esencial en la regulación de la activación de las células T. Controla el equilibrio inmunológico evitando la acumulación de células T autorreactivas [ 13 ]. El PD-1 se ha caracterizado como un regulador negativo de las células T CD4 + convencionales. Además, PD-L1 y PD-L2 tienen un papel esencial pero opuesto en las funciones de modulación y polarización de las células T en hiperreactividad [ 14 ].
2. PD-1 y sus ligandos PD-L1 y PD-L2
La investigación sobre el PD-1 y sus ligandos se ha realizado principalmente en el cáncer, y las alergias se han investigado poco. Honjo y colaboradores describieron PD-1 en 1992 [ 22 ]; unos años más tarde, en 1999, Lieping Chen describió su ligando PD-L1 [ 23 ]. PD1 se expresa en varios tipos de células, incluidas células T CD4 + y CD8 + activadas, células B, asesinos naturales (NKT), monocitos-macrófagos, APC y linfocitos CD11c + CD mieloides que infiltran tumores [ 24 , 25 , 26]. PD-1 se expresa principalmente en timocitos durante el desarrollo embrionario y en linfocitos inmaduros CD4 y CD8. También se puede expresar en tejidos linfáticos ingenuos (LT), LT latentes, eosinófilos, basófilos y mastocitos. También se puede expresar en otras líneas celulares no hematopoyéticas como neuronas, queratinocitos, células endoteliales, fibroblastos, placenta, retina y folículos pilosos [ 27 , 28 ]. Las citocinas comunes de la cadena ɣ, IL-2, IL-7, IL-15 e IL-21, pueden inducir la expresión de PD-1 en las células T [ 29 ]. El PD-1 se ha relacionado como un modulador de las respuestas inmunitarias porque los ratones deficientes en PD-1 desarrollaron fenotipos autoinmunes [ 30]; también desempeñan un papel importante en la presentación de antígenos por las CD a las células T CD8 + mediante la regulación de la modulación por disminución de TCR inducida por ligando [ 31 ].
Dong y sus colegas describieron un tercer miembro de la familia B7, llamado B7-H1 (PD-L1). Informaron que PD-L1 coestimula las células T a través de un receptor diferente de CD28, CTLA4 o ICOS (coestimulador inducible) y envía una señal de activación a las células T [ 23 ]. La proteína PD-L1 se expresa de forma constitutiva en células hematopoyéticas y no hematopoyéticas como las CD, los granulocitos, las células T, las células B y las células tumorales [ 32 , 33 , 34 ]. En los macrófagos por LPS, IFN-γ, factor estimulante de colonias de granulocitos-macrófagos (GM-CSF) y células T, células B más DC, la expresión de PD-1 y sus ligandos está regulada por citocinas proinflamatorias. IFN, TNF-α. IL-2, IL-7 e IL-10 e IL-15 estimulan la expresión de PD-L1 en la membrana celular. ( Figura 2) [ 25 ]. Se requiere una administración frecuente de anti-PD-L1, como atezolizumab, para el tratamiento del cáncer porque PD-L1 tiene un alto contenido de células mieloides circulantes [ 35 ]. La expresión de PD-L1 en tejidos no linfoides sugiere que puede regular la función de las células inmunitarias autorreactivas en los tejidos periféricos o puede regular las respuestas inflamatorias [ 22 ]. PD-1 es un freno temprano que afina la activación de las células T durante la presentación del antígeno después de la transducción de la señal de TCR. La coestimulación de PD-L1 / PD-1 en las CD presentadoras de antígeno contribuye a la modulación por disminución de TCR inducida por PD-L1 [ 31 ]. Además, PD-L1 estimula la producción de IL-10 por las células T [ 23 , 36]. A diferencia de PD-L1, PD-L2 rara vez se expresa en células en reposo y solo puede inducirse en DC, macrófagos y mastocitos cultivados derivados de la médula ósea. La regulación de PD-L2 es por IL-4 y GM-CSF. PD-L2 puede inducirse en macrófagos por IL-4 e IFNγ y CD por anti-CD40, GM-CSF, IL-4, IFN-γ e IL-12 [ 25 , 37 ].
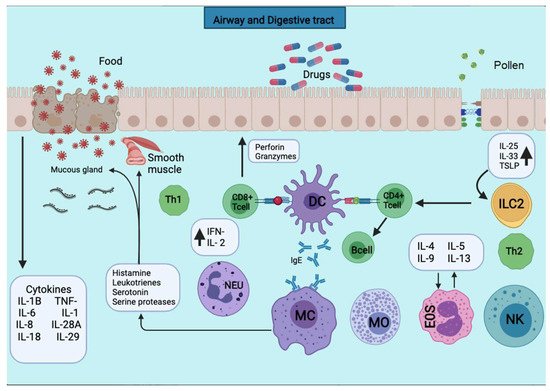
Figura 2. Las APC presentan los antígenos a la subpoblación de células T CD4 + para su activación. Las APC toman el primer contacto de sensibilización con el antígeno, lo unen a las moléculas del MHC de clase II y lo exponen a la membrana. Las APC toman el primer contacto sensibilizante con el antígeno, que lo procesa y lo une a las moléculas del MHC de clase II y lo expone a la membrana. Se liberan varias citocinas como TNF-a, IL-1, IL-4, IL-5, IL-6, IL-13, MIP-1a y varios factores estimulantes de colonias como GM-CSF e IL-3. El desencadenamiento de la reacción alérgica es estimulado por la producción de IgE por los linfocitos B. La producción de IgE estimula el desencadenamiento de la reacción alérgica por parte de los linfocitos B. La IgE se unirá a los mastocitos y basófilos para la desgranulación y la liberación de varios mediadores.
La expresión de PD-L1 y PD-L2 depende de distintos estímulos, y sus patrones de expresión sugieren funciones tanto superpuestas como diferenciales en la regulación inmunitaria [ 38 , 39 ]. Estos nuevos datos sugieren resultados opuestos informados con respecto a la función PD-1 [ 40 ]. Muchas citocinas juegan un papel esencial en la inducción o el mantenimiento de la expresión de PD-L1. Estudios in vitro e in vivo han demostrado que la expresión de la proteína PD-L1 en APC, linfocitos T reguladores y células cancerosas dependía fuertemente de la existencia de citocinas proinflamatorias: IL-1β, TNF-α, IL-6, también como IL-2, IL-7, IL-15 e IL-21. Además, los IFN de tipo I y tipo II son el segundo mecanismo impulsado por los oncogenes (cascada de ciclina D-CDK4) [ 36 , 41 , 42, 43 , 44 ]. La función de PD-L1 es mantener la tolerancia periférica y contribuir a la presentación de antígenos a las células T por las células dendríticas [ 42 ]. PD-L1 se regula al alza en respuesta a la inflamación y suprime las respuestas inmunitarias excesivas, lo que puede causar una lesión tisular innecesaria. Las células tumorales que surgen de células normales adoptan este mecanismo para evadir la inmunidad tumoral. Supresión de linfocitos T para PD-L1 en el microambiente tumoral. Del mismo modo, PD-L1 se regula al alza para inhibir la apoptosis en muchas células y regular el metabolismo de la glucosa [ 45 , 46 ]. El PD-1 y sus ligandos parecen desempeñar un papel esencial en el mantenimiento de la homeostasis de las células T en el cáncer y las enfermedades alérgicas.
3. PD-1 y sus ligandos en las enfermedades alérgicas
La respuesta inmune de tipo 2 representa la respuesta inmune principal y clínicamente más relevante en las enfermedades alérgicas. PD-1 y sus ligandos tienen un papel esencial en el mantenimiento de la homeostasis de las células T a través de las células T-B reguladoras (Tregs y Bregs) ( Figura 3 ) [ 47 ]. La siguiente sección resume los nuevos conocimientos de PD-1 y sus ligandos, PD-L1 y PD-L2, en enfermedades alérgicas que incluyen asma alérgica, respuesta inmune de la piel, rinoconjuntivitis, alergia alimentaria y anafilaxia.
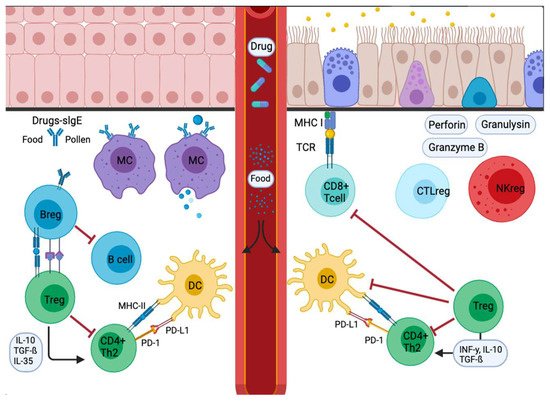
Figura 3. Señal de respuesta alérgica en cascada inflamatoria en mucosas. Los alérgenos entrantes son absorbidos y procesados por APC o anticuerpos. Los alérgenos atraviesan la mucosa y luego se trasladan a la pleura pulmonar o al intestino. En la etapa de sensibilización, las APC presentan el antígeno y dan una respuesta inmediata. Otros migran a los ganglios linfáticos de drenaje, donde el alérgeno procesado se presenta a las células T y B vírgenes, con respuestas caracterizadas e influenciadas por las citocinas secretadas y la presencia o ausencia de moléculas coestimuladoras unidas a las células. La disminución del estímulo y / o la presencia de IL-10, IL-35 o TGF-β desencadenan la transformación de las células Treg. Además, las APC conducen a la producción de citocinas que regulan el cambio y la expresión de receptores coinhibidores como PD1 / PD-L1.
This entry is adapted from the peer-reviewed paper 10.3390/ijms222111898
References
- Han, X.; Krempski, J.W.; Nadeau, K. Advances and novel developments in mechanisms of allergic inflammation. Allergy 2020, 75,
- 3100–3111. [CrossRef] [PubMed]
- Siracusa, M.C.; Kim, B.S.; Spergel, J.M.; Artis, D. Basophils and allergic inflammation. J. Allergy Clin. Immunol. 2013, 132, 789–801.
- [CrossRef] [PubMed]
- van de Veen, W.; Wirz, O.F.; Globinska, A.; Akdis, M. Novel mechanisms in immune tolerance to allergens during natural allergen
- exposure and allergen-specific immunotherapy. Curr. Opin. Immunol. 2017, 48, 74–81. [CrossRef] [PubMed]
- Stock, P.; DeKruyff, R.H.; Umetsu, D.T. Inhibition of the allergic response by regulatory T cells. Curr. Opin. Allergy Clin. Immunol.
- 2006, 6, 12–16. [CrossRef]
- Hansbro, P.M.; Kaiko, G.E.; Foster, P.S. Cytokine/anti-cytokine therapy-novel treatments for asthma? Br. J. Pharmacol. 2011, 163, 81–95.
- [CrossRef]
- Wing, K.; Sakaguchi, S. Regulatory T cells as potential immunotherapy in allergy. Curr. Opin. Allergy Clin. Immunol. 2006, 6, 482–488.
- Wang, W.; Li, Y.; Lv, Z.; Chen, Y.; Li, Y.; Huang, K.; Corrigan, C.J.; Ying, S. Bronchial Allergen Challenge of Patients with Atopic Asthma
- Triggers an Alarmin (IL-33, TSLP, and IL-25) Response in the Airways Epithelium and Submucosa. J. Immunol. 2018, 201, 2221–2231.
- Gubernatorova, E.O.; Namakanova, O.A.; Tumanov, A.V.; Drutskaya, M.S.; Nedospasov, S.A. Mouse models of severe asthma for
- evaluation of therapeutic cytokine targeting. Immunol. Lett. 2019, 207, 73–83. [CrossRef]
- Gubernatorova, E.O.; Namakanova, O.A.; Gorshkova, E.A.; Medvedovskaya, A.D.; Nedospasov, S.A.; Drutskaya, M.S. Novel
- Anti-Cytokine Strategies for Prevention and Treatment of Respiratory Allergic Diseases. Front. Immunol. 2021, 12, 1704. [CrossRef]
- Kuruvilla, M.E.; Lee, F.E.-H.; Lee, G.B. Understanding Asthma Phenotypes, Endotypes, and Mechanisms of Disease. Clin. Rev.
- Allergy Immunol. 2019, 56, 219–233. [CrossRef]
- Agache, I.; Sugita, K.; Morita, H.; Akdis, M.; Akdis, C.A. The Complex Type 2 Endotype in Allergy and Asthma: From Laboratory
- to Bedside. Curr. Allergy Asthma Rep. 2015, 15, 29. [CrossRef] [PubMed]
- Mittal, S.K.; Roche, P.A. Suppression of antigen presentation by IL-10. Curr. Opin. Immunol. 2015, 34, 22–27. [CrossRef]
- Canavan, M.; Floudas, A.; Veale, D.J.; Fearon, U. The PD-1:PD-L1 axis in Inflammatory Arthritis. BMC Rheumatol. 2021, 5, 1.
- Schwamborn, K. Imaging mass spectrometry in biomarker discovery and validation. J. Proteomics 2012, 75, 4990–4998. [CrossRef]
- [PubMed]
- Okuyama, Y.; Nagashima, H.; Ushio-Fukai, M.; Croft, M.; Ishii, N.; So, T. IQGAP1 restrains T-cell cosignaling mediated by OX40.
- FASEB J. 2020, 34, 540–554. [CrossRef]
- Agache, I.; Akdis, C.A. Precision medicine and phenotypes, endotypes, genotypes, regiotypes, and theratypes of allergic diseases.
- J. Clin. Invest. 2019, 129, 1493–1503. [CrossRef]
- Alarcón, B.; Mestre, D.; Martínez-Martín, N. The immunological synapse: A cause or consequence of T-cell receptor triggering?
- Immunology 2011, 133, 420–425. [CrossRef]
- Yokosuka, T.; Saito, T. The immunological synapse, TCR microclusters, and T cell activation. Curr. Top. Microbiol. Immunol. 2010,
- 340, 81–107. [CrossRef]
- Kucuksezer, U.C.; Ozdemir, C.; Cevhertas, L.; Ogulur, I.; Akdis, M.; Akdis, C.A. Mechanisms of allergen-specific immunotherapy
- and allergen tolerance. Allergol. Int. 2020, 69, 549–560. [CrossRef]
- Stone, S.F.; Phillips, E.J.; Wiese, M.D.; Heddle, R.J.; Brown, S.G.A. Immediate-type hypersensitivity drug reactions. Br. J. Clin.
- Pharmacol. 2014, 78, 1–13. [CrossRef]
- Jubel, J.M.; Barbati, Z.R.; Burger, C.; Wirtz, D.C.; Schildberg, F.A. The Role of PD-1 in Acute and Chronic Infection; Frontiers:
- Lausanne, Switzerland, 2020; Volume 11, p. 487.
- Ishida, Y.; Agata, Y.; Shibahara, K.; Honjo, T. Induced expression of PD-1, a novel member of the immunoglobulin gene
- superfamily, upon programmed cell death. EMBO J. 1992, 11, 3887–3895. [CrossRef]
- Dong, H.; Zhu, G.; Tamada, K.; Chen, L. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin10 secretion. Nat. Med. 1999, 5, 1365–1369. [CrossRef]
- Agata, Y.; Kawasaki, A.; Nishimura, H.; Ishida, Y.; Tsubat, T.; Yagita, H.; Honjo, T. Expression of the PD-1 antigen on the surface
- of stimulated mouse T and B lymphocytes. Int. Immunol. 1996, 8, 765–772. [CrossRef]
- Yamazaki, T.; Akiba, H.; Iwai, H.; Matsuda, H.; Aoki, M.; Tanno, Y.; Shin, T.; Tsuchiya, H.; Pardoll, D.M.; Okumura, K.; et al.
- Expression of Programmed Death 1 Ligands by Murine T Cells and APC. J. Immunol. 2002, 169, 5538–5545. [CrossRef]
- Boussiotis, V.A. Molecular and Biochemical Aspects of the PD-1 Checkpoint Pathway. N. Engl. J. Med. 2016, 375, 1767–1778.
- mechanisms of interaction with PD-1. Int. Immunol. 2010, 22, 651–660. [CrossRef] [PubMed]
This entry is offline, you can click here to edit this entry!
