Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Biotechnology & Applied Microbiology
La termografía infrarroja (IRT) es una técnica no ionizante y no invasiva que permite evaluar los niveles de confort de los animales.
- animal welfare
- Bubalus bubalis
- cows
- infrared thermography
- thermal window
- river buffalo
1. Introducción
La termografía infrarroja (IRT) es una herramienta que se utiliza cada vez más con animales de granja debido al creciente interés de la sociedad por el bienestar animal [ 1 , 2 , 3 , 4 ]. Esta técnica detecta el calor irradiado por una superficie, decodificándolo en una temperatura por un cuerpo biológico e interpretando su relación con el estado de confort animal [ 5 ]. En términos de mecanismos tanto fisiológicos como prácticos, el principal mecanismo involucrado en la ganancia o pérdida de calor es la regulación del diámetro de los vasos sanguíneos cercanos a la superficie; es decir, la vasodilatación cutánea que ocurre en regiones anatómicas para permitir intercambios térmicos con el ambiente [ 6 , 7 , 8 ,9 , 10 , 11 ]. Estas regiones, conocidas como ventanas térmicas [ 12 , 13 , 14 , 15 , 16 ], se caracterizan por una densa red de vasos sanguíneos, la presencia de plexos, anastomosis arteriovenosa y ausencia de cabello [ 7 , 8 ]. Diversos autores sostienen que estas regiones permiten evaluar el estado de salud de un animal de forma no estresante [ 17 , 18 , 19 , 20 , 21]. Además de ser una técnica no invasiva, es fácil de aplicar y, en algunos casos, más económica que los métodos convencionales (p. Ej., Predecir el consumo residual de alimentos) [ 22 , 23 ].
Desde una perspectiva fisiológica, los cambios en el flujo sanguíneo son esenciales porque permiten el intercambio térmico entre la piel de un animal y el medio ambiente a través de la vasoconstricción y vasodilatación controladas por la respuesta vasomotora noradrenérgica simpática de los músculos lisos [ 24 ]. La adopción de este enfoque ha mejorado nuestra comprensión de las estrategias de termorregulación características de diferentes especies en condiciones de frío, como la reducción del tamaño de la cola y las orejas en algunos animales, la cola de las ratas de laboratorio o las almohadillas digitales ( torus digitalis ) de los gatos. , todos los cuales funcionan como ventanas térmicas que pueden disipar el calor [ 9 , 20 , 25 , 26 , 27]. Sin embargo, los análisis realizados en este campo nos llevaron a cuestionar la utilidad y viabilidad de las ventanas térmicas actualmente sugeridas para los grandes rumiantes, ya que ciertos aspectos anatómicos —cabello, color de piel o su ausencia y grosor de la piel— pueden afectar determinadas ventanas térmicas. haciéndolos inviables en estas especies, aunque son efectivos en otras [ 21 , 28 ]. Estos factores también impiden la validación de estas ventanas, como se ha logrado con otras [ 29 ]. Sin embargo, la evidencia disponible señala las siguientes regiones como posibles ventanas térmicas para el ganado y los búfalos de río: la carúncula lagrimal del ojo en la región orbitaria ( regio orbitalis ), el hocico y la nariz externa de la región nasal ( regio nasalis).), la glándula mamaria de la región de la ubre ( regio uberis ) y la vulva de la región urogenital ( r egio urogenitalis ) [ 30 , 31 ].
La elección de una ventana térmica que sea sensible y específica es de vital importancia para evaluar el estado fisiológico de los animales y, al mismo tiempo, minimizar las influencias externas en los resultados [ 32 ].
2. Ubicaciones anatómicas de las ventanas térmicas en bovinos y búfalos de río
La IRT es una técnica no invasiva y no ionizante que permite evaluar el estado térmico de un cuerpo biológico detectando cambios en la radiación de onda larga (infrarroja) emitida por regiones anatómicas específicas [ 32 , 33 ]. Las principales características que requieren estas zonas topográficas son una alta densidad de vasos sanguíneos cercanos a la superficie, la ausencia de pelo o pelaje y anastomosis arteriovenosa. Estas condiciones existen, por ejemplo, en el ojo de la región orbitaria ( regio orbitalis ) [ 34 , 35 ], el pabellón auricular de la oreja en la región auricular ( regio auricularis ), o son atravesadas por vasos grandes y rectos, como en la región de la cola ( regio caudalis) de ratas. Las regiones que satisfacen estos requisitos se denominan ventanas térmicas [ 16 , 30 , 36 , 37 ]. La alta densidad de los vasos sanguíneos cerca de la superficie dérmica es crítica porque las modificaciones de su diámetro afectan el flujo sanguíneo y cambian la tasa de intercambio de calor en la zona [ 38 ]. La vasodilatación permite aumentar la pérdida sensible de calor, mientras que la vasoconstricción ejerce el efecto contrario mediante el control de la respuesta vasomotora de las fibras adrenérgicas simpáticas en el músculo liso de los vasos sanguíneos y en el núcleo pálido del rafe rostral de la médula espinal, que regulan el proceso de termorregulación sistémica [ 24 , 39 ].
Los estudios han descrito que el rafe medular participa significativamente en el control de la actividad vasomotora, ya que contiene neuronas GABAérgicas (ácido gamma aminobutírico) que permiten el flujo sanguíneo cerca de la superficie cutánea a través de la vasoconstricción y vasodilatación de los vasos sanguíneos [ 24 ]. En estudios experimentales, se ha demostrado lo anterior donde la supresión de estas neuronas con antagonistas del receptor GABAérgico inhibe la capacidad de vasodilatación en las regiones de la cola de rata ( regio caudalis ) y orejas de conejo en la región auricular ( regio auricularis ) [ 40 , 41 ].
Otro aspecto de subrayado es la disposición del tejido adiposo, que también desempeña una función crítica en la termorregulación, como en las regiones interescapulares de corderos y ratones recién nacidos. En este caso, durante la exposición a condiciones climáticas frías, la densidad vascular aumenta significativamente y activa la angiogénesis que, a su vez, provoca un aumento de la actividad metabólica en la zona en forma de respuesta termogénica sin escalofríos [ 26 , 42 ].
En resumen, en respuesta a cambios significativos en las temperaturas ambientales, los termorreceptores en la piel comienzan a transmitir hacia el rafe medular y el núcleo preóptico mediano del hipotálamo (MnPO), donde la señalización eferente de las neuronas simpáticas ejerce una acción vasomotora al cambiar el diámetro de vasos sanguineos. Los termorreceptores perciben la sensación térmica, formada por canales iónicos denominados receptores de potencial transitorio (TRP), que detectan diferentes rangos de temperatura. Esto, a su vez, permite regular la radiación térmica en la superficie [ 43 ]. Este fenómeno se presenta en la Figura 1 .
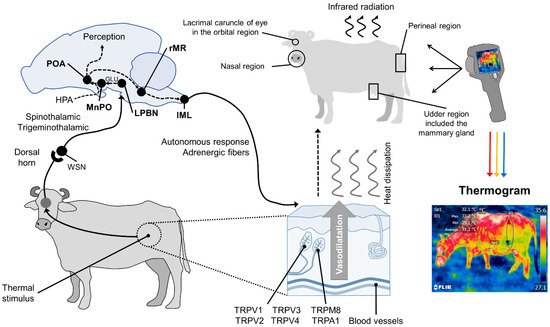
Figura 1.Neuromodulación hipotalámica de la termorregulación y su respuesta cutánea. En los mamíferos, la respuesta termorreguladora comienza en la periferia con termorreceptores en la dermis, principalmente vainilloides potenciales de receptores transitorios activados por calor (TRPV, TRPV1, TRPV2, TRPV3, TRPV4), o receptores de frío, llamados potenciales de receptores transitorios relacionados con la melastatina (TRPM8, TRPA1). Estos reciben información aferente de un estímulo térmico y envían la señal a las láminas del asta dorsal de la médula espinal. Las neuronas espinotalámicas y trigéminotalámicas sensibles al calor (WSN) en esta zona transmiten el impulso a las neuronas de tercer orden en las estructuras cerebrales, como el núcleo parabraquial lateral (LPBN). Desde allí, se proyectan por influencia glutamatérgica (GLU), al núcleo preóptico mediano (MnPO) en el área preóptica (POA) del hipotálamo. La red hipotalámica es responsable de la integración de las respuestas efectoras termoreguladoras conductuales, neuroendocrinas (mediadas por el eje hipotalámico-pituitario-suprarrenal (HPA)) y autonómicas. La acción autónoma, mediada por ganglios adrenérgicos simpáticos que reciben información del rafe medular rostral (rMR) y del núcleo intermediolateral lateral de la médula espinal (IML), induce vasodilatación cutánea con la consiguiente disipación de calor en forma de radiación infrarroja a través de determinadas regiones corporales , conocidas como ventanas térmicas (p. ej., la carúncula lagrimal del ojo en la región orbitaria (regio orbitalis ), el hocico en la región nasal ( región nasalis ), la glándula mamaria en la región de la ubre ( regio uberis ) y la vulva de la región urogenital ( r egio urogenitalis ). Las cámaras termográficas de infrarrojos pueden capturar la radiación emitida a través de la piel mediante un código de colores que permite determinar las temperaturas mínima, media y máxima de la ventana térmica evaluada.
Sin embargo, desde una perspectiva comparativa, existen diferencias entre los sitios anatómicos involucrados en el intercambio térmico. El reconocimiento de estas diferencias ha llevado a una mejor comprensión de los mecanismos vasculares implicados en la termorregulación [ 25 ]. Un ejemplo es la distribución de glándulas en espacios interdigitales en perros y gatos que funcionan para disipar el calor, mientras que en rumiantes y ratas de laboratorio, la reducción del tamaño de la cola en condiciones ambientales frías es importante [ 16 , 20 , 26 , 27 ].
Los estudios mencionan similitudes usando ciertas regiones, como las colas en roedores y bovinos, que se correlacionan positivamente con la temperatura corporal. En esta región, tanto en la cola de rata como en la de bovino, los grandes vasos rectos ayudan a la termorregulación [ 20 ], y la validación de las ventanas térmicas requiere una alta sensibilidad y especificidad para predecir los estados fisiológicos con precisión. Aunque esto se ha logrado en varias especies [ 44 ], la confiabilidad de este enfoque está limitada por varias condiciones, como la presencia o ausencia de cabello (piel glabra), el grosor del pelaje, el grosor de la piel y el color del pelaje, todos los cuales pueden alterar la ganancia o pérdida de calor [ 45]. Además, estas características establecen diferencias entre especies, como las que existen entre perros y ratas. En este último, la ventana plantar ayuda a evaluar los estados térmicos [ 46 ], pero no ha sido posible validar esta ventana en perros [ 47 ] ( Figura 2 ). Estos hallazgos indican la necesidad de mejorar nuestra comprensión de las diferentes ventanas térmicas a la luz de hallazgos científicos recientes y de analizar su posible utilidad clínica para el trabajo con grandes rumiantes. Estos son los temas que se tratan en las siguientes secciones.
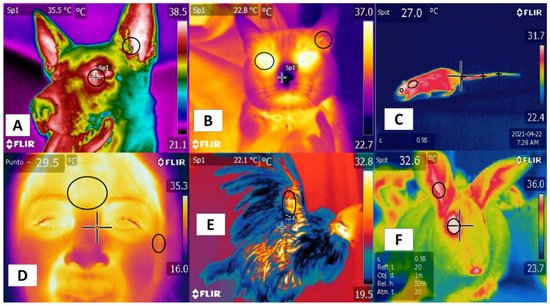
Figura 2. Ventanas térmicas utilizadas en diferentes especies. ( A ) en perros, la carúncula lagrimal en la región orbitaria ( regio orbitalis ) y el pabellón auricular de la oreja en la región auricular ( regio auricularis ); ( B ) en gatos, el ojo en la región orbitaria ( regio orbitalis ) y el pabellón auricular de la oreja en la región auricular ( regio auricularis ); ( C ) en ratas, la región orbital ( regio orbitalis ), la región interescapular y la base de la cola en la región de la cola; ( D ) en humanos, la región frontal y el pabellón auricular del oído en la región auricular (regio auricularis ); ( E ) en gallinas, la región radial; ( F ) en conejos, la región orbital ( regio orbitalis ) y el pabellón auricular de la oreja en la región auricular ( regio auricularis ). Se ha logrado la identificación de diferentes ventanas térmicas para la mayoría de las especies.
Su correlación positiva con la actividad del sistema nervioso autónomo (SNA), específicamente el sistema nervioso simpático (SNSi), se ha logrado debido a su activación, provocando vasoconstricción de los capilares sanguíneos. Sin embargo, este hecho se ha verificado en diferentes regiones, como la orbital ( regio orbitalis ) y la región auricular ( regio auricularis ) en perros y gatos, mientras que en la región frontal humana es posible confirmar esta activación. En ratas, conejos y aves, la cola ( región caudalis ) y las regiones orbitales ( región orbitalis ) y la base radial en la región antebraquial ( regio antebrachii), respectivamente, se han observado como regiones que presentan una correlación positiva con la temperatura corporal y que pueden proporcionar ventanas para evaluar la temperatura de forma no invasiva.
3. Región orbital ( Regio Orbitalis )
Algunos estudios de grandes rumiantes describen la carúncula lagrimal o superficie ocular en la región orbitaria ( regio orbitalis ) como una ventana térmica sensible debido a su característica alta vascularización. Esta es la principal ventaja de esta región; sin embargo, también se han mencionado desventajas, especialmente su susceptibilidad a factores ambientales como el viento, la radiación solar directa y la humedad, todo lo cual puede afectar las evaluaciones [ 48 ] y limitar la validez de considerar esta zona. Esta región tiene fibras simpáticas del nervio facial que inervan los capilares de las arterias facial e infraorbitaria. Se sabe que esta red vascular y nerviosa periférica responde a estímulos estresantes o dañinos. Está representado en la Figura 3, que muestra la ubicación de la región orbitaria en el canto medial de los párpados [ 30 , 49 , 50 , 51 ]. Estas fibras son sensibles a la neurosecreción de epinefrina y norepinefrina que promueve la vasoconstricción en los capilares, reduciendo así la tasa de intercambio de calor y funcionando como un mecanismo termorregulador local [ 14 ]. La relación de la actividad del sistema nervioso autónomo (SNA) con las fluctuaciones en la temperatura de la región orbital proporciona las características térmicas de esta ventana [ 52 , 53 ].
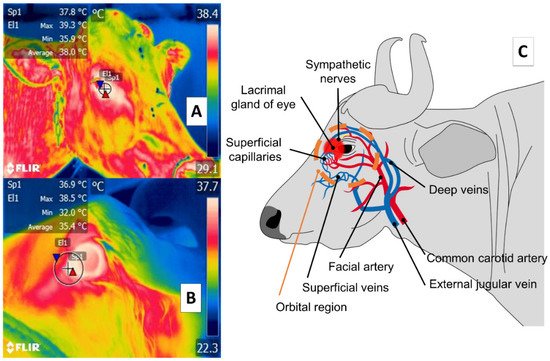
Figura 3. Ventana térmica ocular, o carúncula lagrimal del ojo en la región orbitaria ( región orbital ) ( A ) bovinos ( Bos ); ( B ) búfalo de río ( Bubalus bubalis). Esta ventana térmica está delimitada por un círculo o cuadrado trazado desde la región medial del ojo 3 o 4 mm hacia el área rostral de la comisura palpebral medial o canto en la porción central del círculo alrededor de la glándula lagrimal. Esta zona se caracteriza por una alta densidad de capilares de las arterias maxilar e infraorbitaria que están inervados por fibras simpáticas. Cuando se estimulan, estas fibras provocan una neurosecreción de epinefrina y norepinefrina que desencadena la vasoconstricción y la consecuente disminución de la tasa de intercambio de calor, como ocurre en condiciones de estrés o nocicepción, como se muestra en la parte ( C ) de la figura.
Stewart y col. [ 53] evaluó la detección del dolor durante el descornado. El estudio se realizó con 46 terneros, Holstein-Friesian de 6 semanas de edad. Hubo seis tratamientos (1) control; (2) descornado con hierro caliente; (3) anestesia local y descornado; (4) control de la anestesia local; (5) control de anestésicos locales y antiinflamatorios no esteroideos; (6) anestésico local, un fármaco antiinflamatorio no esteroideo y descornado. Su estudio identificó variaciones de temperatura superficial en la carúncula lagrimal del ojo y midió la variabilidad de la frecuencia cardíaca. Observaron que tanto la temperatura de la región orbital como la frecuencia cardíaca (FC) aumentaron significativamente durante el descornado en comparación con las respuestas basales. La temperatura de la carúncula lagrimal del ojo, sin embargo, disminuyó 5 min después del procedimiento, mientras que en los animales tratados con ACTH no se generó respuesta.
Resultados similares se describieron en un estudio posterior de terneros de 30 y 4 semanas de edad sometidos a castración y divididos en tres grupos experimentales (uno que recibió anestesia local, otro sin anestesia y un control). Ese estudio analizó parámetros fisiológicos (FC y variabilidad de la frecuencia cardíaca), la temperatura de la carúncula lagrimal del ojo y los niveles de catecolaminas. Los resultados de los tres grupos mostraron un aumento significativo en la frecuencia cardíaca, la variabilidad de la frecuencia cardíaca y la temperatura de la carúncula lagrimal del ojo durante el procedimiento quirúrgico en comparación con los parámetros basales. Además, hubo una respuesta sincrónica de norepinefrina y epinefrina con las otras variables. Además, en los animales no anestesiados, una reducción significativa de la temperatura de la carúncula lagrimal del ojo de 1 ± 0.54 ]. En otro estudio, monitorear la temperatura del globo ocular en la región orbital en 23 bovinos primíparos (raza Canchim) durante seis meses fue un medio preciso para estimar la temperatura corporal interna y evaluar el estado fisiológico de los animales [ 55 ].
Esta investigación sustenta la existencia de una relación entre una respuesta térmica a nivel ocular en la región orbitaria ( regio orbitalis ) y la acción del SNA a través de la activación de la parte simpática del sistema nervioso autónomo (SyNS), que induce la neurosecreción de catecolaminas en condiciones de dolor y estrés. Además, la activación del SyNS induce una vasoconstricción periférica que reduce la temperatura de la superficie, como se observa en el modelo bovino que utiliza la carúncula lagrimal del ojo [ 54 , 56 ]. Los autores del presente artículo de revisión buscaron demostrar este fenómeno en un estudio preliminar representado en la Figura 4 .
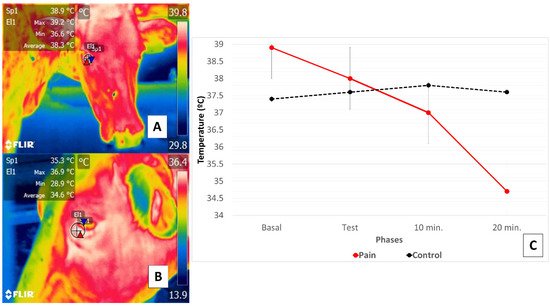
Figura 4. Comparación de cambios en la respuesta térmica de la carúncula lagrimal del ojo en bovinos (vaca Holstein) durante la percepción del dolor causado por claudicación por laminitis. Este estudio comparó la respuesta térmica de la carúncula lagrimal del ojo en cuatro bovinos sanos en condiciones de dolor producido por claudicación de segundo grado de una extremidad pélvica [ 54 ]. Los animales se sometieron a una prueba de Sprecher [ 57 ] para evaluar la marcha. ( C ) muestra que en los animales con claudicación, los registros de temperatura basal ( A ) comenzaron a 38,9 ° C, seguidos de una disminución progresiva de 0,9 ° C durante la prueba mantenida a los 10 y 20 min post-prueba, cuando una reducción total de 3.3 ° C se registró ( B). Los resultados para los animales sanos, por el contrario, mostraron que la temperatura basal comenzó a 37,4 ° C pero aumentó durante la prueba y a las 10 después de la prueba en 0,4 ° C, seguida de una disminución de 0,2 ° C. Así, el fenómeno observado en los animales con claudicación se atribuyó a percepciones de dolor que provocaban una mayor reactividad hemodinámica mediada por la neurosecreción de catecolaminas que provocaban la vasoconstricción de los capilares superficiales. Esta respuesta fisiológica se reflejó en la respuesta térmica de la carúncula lagrimal del ojo por la disminución del intercambio térmico observado allí.
En esta línea de investigación, Lowe et al. [ 58 ] adaptó el IRT a los sistemas automatizados de alimentación de terneros en las operaciones de cría de ganado para mejorar la productividad y el bienestar de los animales. En un estudio de 120 terneros, se determinaron las temperaturas de la mejilla y la región orbital ( regio orbitalis ) utilizando métodos automáticos y convencionales. Sin embargo, ambas técnicas y ambas regiones faciales ( regiones faciei ) lograron fuertes niveles de concordancia (ojo: r 2 = 0,99, p <0,001; mejilla en 3 × 3 píxeles y 9 × 9 píxeles: r 2 = 0,85, p <0,001 y r 2 = 0,90, p<0,001, respectivamente) que fueron mayores para la superficie ocular en la región orbitaria debido a la variabilidad en las regiones específicas de las mejillas analizadas. La importancia de este estudio es que a través del monitoreo infrarrojo continuo de los animales, la TRI puede funcionar como una herramienta para la detección temprana de estados patológicos, dolorosos y emocionales al distinguir más fácilmente las alteraciones en la temperatura de las ventanas térmicas. Los estudios del búfalo de río mencionan que la ventana ocular se puede utilizar como indicador del confort térmico [ 21 , 30 , 31 ]. En este contexto, Chikkagoudara et al. [ 59] encontraron que la temperatura de la carúncula lagrimal del ojo aumentó hasta 5 ° C en comparación con un control en veinticuatro búfalos de río de 16 a 18 meses de edad con un peso promedio de 301 ± 8,24 kg durante condiciones experimentales diseñadas para inducir estrés térmico similar al de los días calurosos y secos de verano.
Por el contrario, Scoley et al. [ 60 ] realizaron estudios con 16 terneros Holstein lecheros machos y hembras de 17 días de edad. Compararon imágenes térmicas radiométricas de las regiones orbital ( regio orbitalis ) y anal ( regio analis ) con lecturas de temperatura rectal durante cinco días consecutivos. Los resultados mostraron sólo una correlación baja (r 2 = 0,24) entre la región orbitaria y la temperatura corporal, pero produjeron una correlación positiva entre las regiones orbitaria y anal (r 2 = 0,43). Sus hallazgos difieren de los reportados por Athaíde et al. [ 61 ], que encontró una correlación positiva (r 2= 0,65) de las temperaturas máxima, mediana y mínima de la carúncula lagrimal del ojo y la región orbitaria con las temperaturas rectales de las hembras de búfalo Murrah en dos condiciones climáticas: con y sin acceso a la sombra. Otro estudio que incluyó búfalos ( Bubalus bubalis ) informó que las temperaturas oculares en la región orbital tenían una correlación positiva (r 2 = 0,92) con la temperatura corporal en animales alimentados en pastos abiertos [ 62 ].
Además, se ha informado que la sensibilidad y especificidad de la TRI con Bos indicus en un modelo experimental de vacas febriles identificaron correlaciones débiles entre las temperaturas rectal y ocular en la región orbital ( regio orbitalis ) y lecturas del hocico en la región nasal ( regio nasalis ) y la carúncula lagrimal del ojo en la región orbitaria ( regio orbitalis ) (r 2 = 0.38, 0.28, 0.27, respectivamente), con valores de sensibilidad de 88, 90 y 82% para las respectivas regiones, pero baja especificidad que no supere el 32% [ 63 ]. Estos hallazgos sugieren solo una utilidad limitada de la TRI en la región orbital durante los estados febriles en esta especie.
De acuerdo con la evidencia presentada, la ventana térmica de la carúncula lagrimal del ojo en la región orbital muestra solo una débil relación específica entre los estados térmicos y la actividad SyNS [ 64 , 65 ], lo que genera dudas sobre su confiabilidad. Además, diversos factores, tanto endógenos — sexo, edad, raza — y ambientales — hora del día, ubicación — son componentes que podrían afectar las evaluaciones de temperatura y pueden conducir a interpretaciones inadecuadas de las lecturas tomadas en estas regiones corporales, como se ha observado en otras especies, como los equinos [ 66 ].
4. Región nasal ( Regio Nasalis )
Con respecto a la región nasal, la detección de cambios térmicos en la región del hocico, incluidas ambas fosas nasales, responde a la irrigación sanguínea proporcionada por la arteria maxilar y los capilares superficiales. Esta vasculatura se esquematiza en la Figura 5 . A través de esta ventana, es posible evaluar la eliminación del vapor producido durante el proceso respiratorio para determinar de forma no invasiva estados térmicos y frecuencias respiratorias (RR) [ 2 , 12 , 67 ].
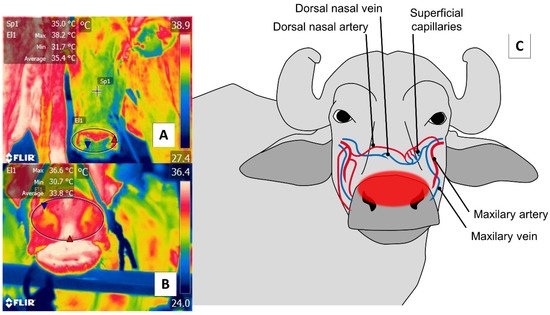
Figura 5. Ventana térmica nasal. ( A ) Bovinos; ( B ) búfalo de río. Se dibuja un círculo (El1) alrededor del hocico de la región nasal ( regio nasalis ) para incluir tanto las fosas nasales como el surco medio. Esta región permite la evaluación de dos condiciones: primero, cambios en la microcirculación de los capilares superficiales de la arteria maxilar, como se muestra en ( C ); en segundo lugar, la eliminación del vapor de agua durante el proceso respiratorio que permite evaluar, a distancia, la frecuencia respiratoria observando cambios en el patrón térmico a nivel central de las fosas nasales.
El primer uso de esta ventana térmica fue informado por Stewart et al. [ 2 ], que integró la TRI con acelerómetros en un estudio de 22 vacas (razas Frisona y Frisona × Jersey) de 5,1 años para evaluar la RR y la respuesta de retroceso, paso y patada (FSK). La respuesta térmica de la ventana del hocico de la región nasal ( regio nasalis ) predijo de manera confiable la variabilidad de la frecuencia cardíaca debido a cambios en la RR. De manera similar a estos resultados, Lowe et al. [ 12 ] informó una alta correlación (r 2= 0,92) al comparar el método convencional de contar los movimientos del área del flanco durante el ciclo respiratorio con las fluctuaciones térmicas alrededor de las fosas nasales mediante registro termográfico en cinco terneros Hereford de 27 ± 3,7 días. Sin embargo, debido a su tamaño y edad, estos animales pueden ser difíciles de evaluar en términos de calentamiento o entrada de aire frío durante la exhalación y la inhalación, respectivamente.
Esos cambios en el vapor liberado en el momento de las exhalaciones, y los cambios en el patrón microvascular de la región que se pueden detectar en imágenes térmicas radiométricas, justifican el uso de esta ventana térmica para determinar estados de salud, de forma automática y remota, en sistemas de producción extensivos. como es el caso de la mayoría de los grandes rumiantes, incluido el búfalo de río [ 30 ]. Para esta especie, la sugerencia es evaluar la ventana nasal y las regiones pectorales ( regiones pectoris) (nervaduras) como ventanas para vincular la temperatura con la eficiencia y el rendimiento productivo. Según una comparación de 75 búfalos de tres grupos genéticos (Jafarabadi, Mediterráneo, Murrah), la TRI permitió clasificar a los animales en grupos de eficiencia baja, media y alta, según la temperatura de regiones corporales específicas [ 68 ]. Sin embargo, la utilidad de la TRI para determinar el RR a distancia aún no está bien establecida en esta especie, aunque sí lo es para el ganado.
Como resultado, la ventana de la región nasal ( regio nasalis y regio naris ) se considera actualmente solo una opción potencial para estimar los estados de salud y determinar el RR de forma remota en los grandes rumiantes. Sin embargo, como ocurre en la medicina humana, se requieren aplicaciones clínicas para definir el grado de sensibilidad y especificidad en diferentes especies animales [ 69 ].
5. Región de la ubre ( Regio Uberis ) y glándula mamaria
La región de la ubre ( regio uberis ), incluida la glándula mamaria, es otra región anatómica esencial, debido a condiciones clínicas (p. Ej., Mastitis) que tienen graves repercusiones en la producción cuando los casos se vuelven agudos. Como muestra la Figura 6 , la ventana de la región de la ubre ( regio uberis ), incluida la glándula mamaria, cubre el cuerpo de tejido mamario para capturar la radiación emitida por la arteria y las venas mamarias. A diferencia del ganado, en los búfalos de río, este enfoque también considera el tejido al nivel del pezón. A pesar de estas diferencias anatómicas, esta ventana térmica se ha utilizado a menudo para detectar casos de mastitis subclínica [ 70 , 71 ].
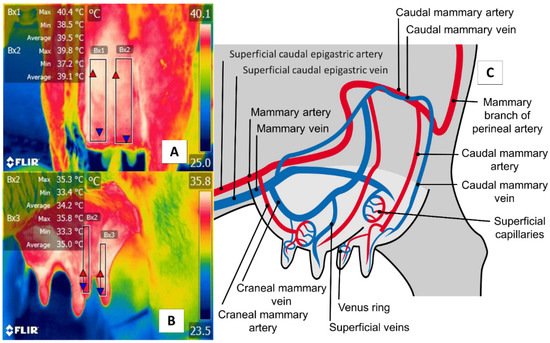
Figura 6. Ventana térmica de la región de la ubre ( regio uberis ), incluida la glándula mamaria, en bovinos lecheros ( Bos ) y búfalos de río ( Bubalus bubalis ). ( A ) Los bovinos lecheros (Holstein Bos Indicus , en producción) se representan en la Figura con un cuadrado (Bx1) que se extiende proximalmente desde la inserción abdominal de la cisterna mamaria y distalmente hasta la inserción del pezón, sin considerar la temperatura de la tetina. último. ( B) Búfalo de río. La ventana se traza desde la región distal del pezón hasta la cisterna de la glándula mamaria. Para esta especie se considera el pezón completo, a diferencia de los bovinos lecheros. Aunque existen diferencias anatómicas significativas entre estas dos especies, se pueden obtener cambios microcirculatorios de las arterias y venas mamarias, como se muestra en ( C). La justificación para utilizar esta ventana en TRI se basa en que la mastitis se caracteriza por la colonización bacteriana en la glándula mamaria genera un proceso inflamatorio local debido a la presencia de células proinflamatorias que producen una secreción de prostaglandinas, histamina, serotonina e interleucinas. que, a su vez, desencadenan la vasodilatación de los capilares mamarios, aumentando la temperatura de la región en 1,5 ° C. Este aumento inflamatorio podría correlacionarse con el aumento de células somáticas [ 72 ].
Por ejemplo, en un modelo experimental de mastitis inducida en seis bovinos utilizando IRT, Hovinen et al. [ 73 ] identificaron un aumento de 1,5 ° C en la temperatura de la piel de la glándula mamaria, que pudieron asociar con otros signos de inflamación, como aumentos en el recuento de células somáticas y la temperatura rectal.
Estudios recientes que comparan la prueba de mastitis de California y el recuento de células somáticas sugieren que la TRI es una herramienta muy sensible para detectar mastitis. Un estudio de 62 vacas Pardo Suizo, por ejemplo, encontró una alta correlación positiva entre la TRI, las puntuaciones en la prueba de mastitis de California (r 2 = 0,86) y el recuento de células somáticas (r 2 = 0,73), con una sensibilidad y especificidad que alcanzó 88,9 y 98,9%, respectivamente [ 74 ]. En este caso, los búfalos de río muestran una tendencia similar, según observaciones de Sarubbi et al. [ 71 ], quien informó una correlación positiva (r 2 = 0,64) entre los cambios térmicos en la glándula mamaria y el recuento de células somáticas en 192 hembras con mastitis inducida experimentalmente durante la lactancia.
Los estudios mencionados enfatizan la utilidad de la TRI como técnica para la detección precoz y el diagnóstico de mastitis subclínica en ambas especies. Sin embargo, se sugiere que las evaluaciones de radiación infrarroja en búfalos de río deben considerar condiciones climáticas y productivas no controladas porque, en esta especie, las temperaturas ambientales y los cambios en los patrones respiratorios pueden alterar la respuesta térmica de esta ventana [ 28 ]. Además, pero desde una perspectiva anatómica, las diferencias entre estas especies deben tenerse en cuenta al examinar las imágenes de la TRI, ya que el tejido mamario del búfalo de río tiene ligamentos suspensorios más prominentes y pezones queratinizados más largos [ 30 , 75 ].
Algunos estudios con búfalos de río han cuestionado el uso de esta región para detectar mastitis porque, según Machado et al. [ 70 ], las imágenes térmicas radiométricas de las regiones izquierda y derecha de la ubre posterior presentan correlaciones más altas con el recuento de células somáticas en comparación con las secciones anteriores. Además, sus hallazgos revelaron una diferencia entre las evaluaciones de las regiones de la ubre anterior y posterior que reducen la confiabilidad de esta ventana.
Sin embargo, la evidencia científica analizada sí refleja un claro consenso en cuanto a la relación de los cambios térmicos en la glándula mamaria con una respuesta inflamatoria local derivada de la mastitis clínica, que genera un aumento de temperatura en la región. A pesar de este consenso, se requieren estudios adicionales para determinar la sensibilidad de esta ventana tanto en bovinos como en búfalos de río.
6. Región perineal ( Regio Perinealis )
La región perineal ( regio perinealis ) es el área de superficie sobre el perineo y las partes adyacentes. En las vacas, esta región está limitada dorsalmente por la raíz de la cola y ventralmente por la unión de la ubre. La región perineal ( regio perinealis ) se divide en las regiones anal ( regio analis ) y urogenital ( regio urogenitalis ), incluidas las porciones externas de la vulva [ 76 ]. La ventana térmica de la vulva enmarca la región urogenital ( regio urogenitalis ) en las mujeres. En esta zona, los labios reciben flujo sanguíneo de los capilares pudendos internos, como se muestra en la Figura 7.. Estos capilares sufren una dilatación durante el estro que provoca un aumento de temperatura. Por esta razón, esta región anatómica ha sido estudiada para determinar su utilidad para detectar el inicio del estro [ 29 , 51 ].
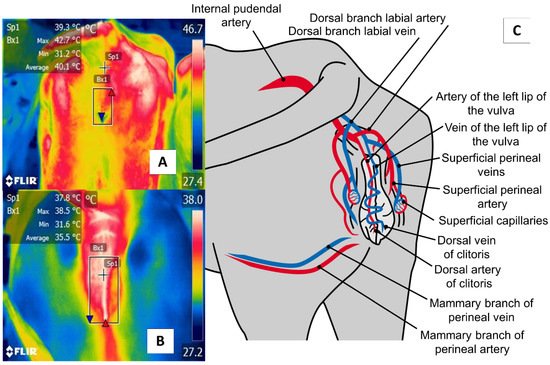
Figura 7. La región perineal ( regio perinealis ), especialmente ventana térmica vulvar, en ganado lechero ( Bos ) ( A ) y búfalos de río ( Bubalus bubalis ) ( B ). Esta ventana está marcada por un cuadrado (Bx) colocado desde la inserción coccígea de la vulva hasta la comisura ventral de esta área, lo que permite tomar lecturas de la circulación de la arteria pudendo interna ( C). Esta arteria emite capilares en los labios vulvares que, durante el estro, responden a incrementos en las concentraciones de prostaglandina E2α que provocan vasodilatación de los capilares y, con ello, mayor irradiación de temperatura durante esta etapa fisiológica que permite la detección del estro en una no manera invasiva.
Radigonda y col. [ 77 ] aplicó IRT para comparar la actividad hormonal ovárica (midiendo los niveles de estrógeno y progesterona), la cría de animales por inseminación artificial y los cambios en la radiación térmica de la ventana vulvar en 150 vacas Bradford no lactantes. Los autores encontraron una diferencia significativa entre la temperatura de los animales que presentaban folículos ováricos y los que no presentaban actividad ovárica (34,2 ± 1,8 ° C y 35,4 ± 1,0 ° C, respectivamente). Concluyeron que las fluctuaciones de temperatura detectadas por IRT podrían proporcionar una herramienta de apoyo para detectar la actividad ovárica y los estados reproductivos.
Estos hallazgos fueron confirmados en un estudio posterior de 18 vacas multíparas bajo un protocolo de estro sincronizado y 18 vacas preñadas utilizadas como grupo de control. Ese estudio evaluó la IRT en varias ventanas térmicas, así como los indicadores de comportamiento del calor, al tiempo que verificaba la condición del ovario mediante ecografía. Los resultados mostraron que la temperatura de la región perineal ( regio perinealis ), especialmente el área vulvar, la región orbitaria ( región orbitalis ), incluyendo el ojo, las regiones faciales ( regiones faciei ) como la mejilla, las regiones del cuello ( regiones colli ), el región marchita ( regio interscapularis ), la región del flanco ( regio abdominis lateralis ) y la región de la grupa (r egio glutea ) todos aumentaron en aproximadamente 1,2 ° C y permanecieron en ese rango durante 24 y 48 h antes de la ovulación, en comparación con el día de la ovulación y cuatro días antes. Estos datos revelan la relación entre la variabilidad de la temperatura en esta región y el estro en el ganado [ 51 ].
Talukder y col. [ 29 ] evaluó la especificidad de la TRI en 30 bovinos hembras que estaban cerca de la ovulación, dirigidos a varias regiones corporales (el ojo en la región orbitaria ( región orbital ) , la oreja en la región auricular ( regio auricularis ), el hocico en la región ( región nasalis ), y la vulva en la región urogenital ( regio urogenitalis)) y realizar dos lecturas al día. Se recolectaron datos sobre niveles de actividad, rumia, concentraciones de progesterona en la leche y registros de inseminación para estimar las fechas de ovulación para llevar a cabo una evaluación más integral. En ese estudio, la TRI de la vulva exhibió una temperatura más alta con una especificidad del 80% pero una sensibilidad baja (21%) en comparación con los otros indicadores utilizados, que determinaron la sensibilidad y especificidad por encima del 80%.
Los estudios del búfalo de río han informado de una respuesta similar, según los hallazgos de Ruediger et al. [ 78 ], que evaluó las oscilaciones de temperatura en la vulva y las concentraciones de progesterona en 40 búfalos Murrah en un protocolo de sincronización con progesterona. Observaron que la temperatura de la vulva aumentaba durante el estro y mantenía una correlación inversamente proporcional a los niveles de progesterona (r 2 = 0,70); es decir, que los niveles de progesterona aumentaron en la medida en que disminuyó la temperatura de la región urogenital ( regio urogenitalis ), especialmente la vulva. Esta relación térmica de la región urogenital y el ciclo estral se describe como hipertermia antes de la ovulación que disminuye posteriormente en ese proceso [ 79]. Sin embargo, la precisión de esta ventana, puede verse afectada por factores ambientales, como la radiación solar o el viento, por lo que es fundamental considerar estos elementos a la hora de reportar valores finales, como también sugieren otros estudios de búfalos de río [ 61 ]. Los cambios climáticos y su vínculo con los parámetros reproductivos fueron analizados por Yadav et al. [ 80 ] en 130 búfalos Murrah machos (toros reproductores). La temperatura de la región escrotal ( regio scrotalis ) y el aumento del gradiente de temperatura dorsal-ventral de esta zona en un clima fresco se asociaron con una mejor calidad del semen que se tradujo en una mayor motilidad y mayores concentraciones de espermatozoides. Esto sugiere que la TRI se puede utilizar como método complementario para las evaluaciones andrológicas en esta especie [ 81 ].
En resumen, la región urogenital ( regio urogenitalis ), especialmente la vulva, es una ventana específica que puede ayudar a determinar la actividad ovárica en grandes rumiantes, donde el comportamiento térmico muestra un aumento de temperatura durante el ciclo estral seguido de una disminución evidente durante la ovulación. Sin embargo, la escasa información disponible sobre esta ventana y los diversos factores ambientales y específicos de especie que intervienen como elementos de variabilidad pueden generar alteraciones en la sensibilidad y especificidad de la TRI. Por tanto, estos elementos requieren de análisis exhaustivos para llegar a conclusiones sobre la utilidad de esta región en bovinos y búfalos de río.
7. IRT y la evaluación de estados patológicos
Inicialmente, la aplicación de la TRI se centró en evaluar procesos inflamatorios en regiones específicas, como la pezuña, donde su uso es importante para la detección temprana de lesiones y dolores inflamatorios que pueden afectar la producción, la ingesta de alimento y el bienestar animal [ 82 , 83 ]. . Cuando los animales padecen laminitis, la TRI puede detectar un aumento de la temperatura de la piel en la banda coronaria [ 84 , 85]. En este sentido, un estudio realizado con 139 vacas lecheras lactantes utilizó IRT para evaluar la respuesta térmica de la banda coronaria y la piel circundante del casco e identificar lesiones en el casco como dermatitis digital y úlceras. La temperatura en los animales heridos fue 2 ° C más alta que en los sujetos sanos. Ese estudio determinó una sensibilidad y una especificidad del 77,8% y el 65,8%, respectivamente [ 86 ].
Un rango similar de especificidad (85,7%) y sensibilidad (82,9) fue encontrado por Alssaod y Büscher [ 87 ], quienes recolectaron 626 imágenes de tres condiciones: 24 vacas lecheras antes y después del corte de pezuñas, animales sanos y animales con algún grado de la cojera. La temperatura de la banda coronaria y la piel tuvo un valor significativamente mayor en las vacas enfermas; sin embargo, factores como la temperatura ambiente y la temperatura de la sala de ordeño tuvieron una correlación positiva (r 2 = 0,92) con las temperaturas del período de recorte. Lo anterior es digno de mención porque es fundamental reconocer la influencia del medio ambiente en las temperaturas superficiales de la piel, como se comenta más adelante.
Otra aplicación sugerida de la TRI en animales es la detección de estados febriles e infecciosos. Durante una respuesta infecciosa, la temperatura corporal aumenta debido a la presencia de IL-1 y PGE2-alfa. Este aumento puede detectarse en imágenes térmicas [ 88 ]. Un estudio que comparó bovinos febriles y no febriles inoculados con Escherichia coli en el cuarto trasero derecho utilizó esta tecnología, complementada con diversas herramientas de análisis geométrico (polígonos, rectángulos y líneas). Encontró que los aumentos de temperatura superiores a 2,06 ° C se detectaron mediante el método sugerido por el autor [ 89 ].
La IRT automatizada también puede ayudar a diagnosticar enfermedades respiratorias complejas en los terneros. En esta línea de investigación, Schaefer et al. [ 90 ] evaluaron 65 terneros lecheros que pesaban ~ 220 kg, expuestos a prácticas industriales y de transporte estándar. La TRI detectó y asoció temperaturas más altas (35,7 ± 0,35 ° C) con enfermedades respiratorias diagnosticadas clínicamente en los animales.
Como muestran estos casos, la TRI es una herramienta valiosa para prevenir y detectar estados patológicos en animales domésticos, debido a las diversas respuestas inflamatorias que aumentan la temperatura del núcleo corporal y de la superficie de la piel, que pueden identificarse como radiación infrarroja [ 20 , 91 , 92 ]. No obstante, es importante considerar la influencia de los factores ambientales en las lecturas de temperatura de los animales evaluados para comprender los resultados y luego implementar estrategias preventivas de manera objetiva.
This entry is adapted from the peer-reviewed paper 10.3390/ani11082247
References
- Petrc, K.; Kinizcova, I. The Use of Infrared Thermography in Livestock Production and Veterinary Field. In Infrared Thermography Recent Advances and Future Trends; Kunc, P., Knizkova, I., Eds.; Bentham Science Publishers: Sharjah, United Arab Emirates, 2012; pp. 85–101.
- Stewart, M.; Wilson, M.T.; Schaefer, A.L.; Huddart, F.; Sutherland, M.A. The Use of Infrared Thermography and Accelerometers for Remote Monitoring of Dairy Cow Health and Welfare. J. Dairy Sci. 2017, 100, 3893–3901.
- Mota-Rojas, D.; Velarde, A.; Maris-Huertas, S.; Cajiao, M.N. Animal Welfare, a Global Vision in Ibero-America; Elsevier Press: Barcelona, Spain, 2016; pp. 1–516.
- Mota-Rojas, D.; Orihuela, A.; Strappini-Asteggiano, A.; Nelly Cajiao-Pachón, M.; Agüera-Buendía, E.; Mora-Medina, P.; Ghezzi, M.; Alonso-Spilsbury, M. Teaching Animal Welfare in Veterinary Schools in Latin America. Int. J. Vet. Sci. Med. 2018, 6, 131–140.
- Zhang, C.; Xiao, D.; Yang, Q.; Wen, Z.; Lv, L. Review: Application of Infrared Thermography in Livestock Monitoring. Trans. ASABE 2020, 63, 389–399.
- Guerrero-Legarreta, I.; Napolitano, F.; Mota-Rojas, D.; Orihuela, A. The Water Buffalo in the Americas, Practical and Experimental Approaches, 2nd ed.; BM Editores: Mexico City, Mexico, 2018; pp. 1–881.
- Napolitano, F.; Mota-Rojas, D.; Guerrero-Legarreta, I.; Orihuela, A. The Latin American River Buffalo, Recent Findings, 3rd ed.; BM Editores: Mexico City, Mexico, 2020; pp. 1–1545.
- Mota-Rojas, D.; Miranda-Córtes, A.; Casas-Alvarado, A.; Mora-Medina, P.; Boscato, L.; Hernández-Ávalos, I. Neurobiology and Modulation of Stress- Induced Hyperthermia and Fever in Animals. Abanico Vet. 2021, 11, 1–17.
- Mota-Rojas, D.; Titto, C.G.; Orihuela, A.; Martínez-Burnes, J.; Gómez-Prado, J.; Torres-Bernal, F.; Flores-Padilla, K.; Carvajal-de la Fuente, V.; Wang, D. Physiological and Behavioral Mechanisms of Thermoregulation in Mammals. Animals 2021, 11, 1733.
- Villanueva-García, D.; Mota-Rojas, D.; Martínez-Burnes, J.; Olmos-Hernández, A.; Mora-Medina, P.; Salmerón, C.; Gómez, J.; Boscato, L.; Gutiérrez-Pérez, O.; Cruz, V.; et al. Hypothermia in Newly Born Piglets: Mechanisms of Thermoregulation and Pathophysiology of Death. J. Anim. Behav. Biometeorol. 2021, 9.
- Reyes-Sotelo, B.; Mota-Rojas, D.; Martínez-Burnes, J.; Olmos-Hernández, A.; Hernández-Ávalos, I.; José, N.; Casas-Alvarado, A.; Gómez, J.; Mora-Medina, P. Thermal Homeostasis in the Newborn Puppy: Behavioral and Physiological Responses. J. Anim. Behav. Biometeorol. 2021, 9, 1–12.
- Lowe, G.; Sutherland, M.; Waas, J.; Schaefer, A.; Cox, N.; Stewart, M. Infrared Thermography—A Non-Invasive Method of Measuring Respiration Rate in Calves. Animals 2019, 9, 535.
- Andrade, D.V. Thermal Windows and Heat Exchange. Temperature 2015, 2, 451.
- Casas-Alvarado, A.; Mota-Rojas, D.; Hernández-Ávalos, I.; Mora-Medina, P.; Olmos-Hernández, A.; Verduzco-Mendoza, A.; Reyes-Sotelo, B.; Martínez-Burnes, J. Advances in Infrared Thermography: Surgical Aspects, Vascular Changes, and Pain Monitoring in Veterinary Medicine. J. Therm. Biol. 2020, 92, 102664.
- Romanovsky, A.A.; Ivanov, A.I.; Shimansky, Y.P. Selected Contribution: Ambient Temperature for Experiments in Rats: A New Method for Determining the Zone of Thermal Neutrality. J. Appl. Physiol. 2002, 92, 2667–2679.
- Hankenson, F.C.; Marx, J.O.; Gordon, C.J.; David, J.M. Effects of Rodent Thermoregulation on Animal Models in the Research Environment. Comp. Med. 2018, 68, 425–438.
- Flores-Peinado, S.; Mota-Rojas, D.; Guerrero-Legarreta, I.; Mora-Medina, P.; Cruz-Monterrosa, R.; Gómez-Prado, J.; Guadalupe Hernández, M.; Cruz-Playas, J.; Martínez-Burnes, J. Physiological Responses of Pigs to Preslaughter Handling: Infrared and Thermal Imaging Applications. Int. J. Vet. Sci. Med. 2020, 8, 71–84.
- Lazaro, C.; Conte-Junior, C.A.; Medina-Vara, M.; Mota-Rojas, D.; Cruz-Monterrosa, R.; Guerrero-Legarreta, I. Effect of Pre-Slaughter Confinement Stress on Physicochemical Parameters of Chicken Meat. Ciênc. Anim. Bras. 2019, 20.
- Tattersall, G.J. Infrared Thermography: A Non-Invasive Window into Thermal Physiology. Comp. Biochem. Physiol. Mol. Integr. Physiol. 2016, 202, 78–98.
- Mota-Rojas, D.; Olmos-Hernández, A.; Verduzco-Mendoza, A.; Lecona-Butrón, H.; Martínez-Burnes, J.; Mora-Medina, P.; Gómez-Prado, J.; Orihuela, A. Infrared Thermal Imaging Associated with Pain in Laboratory Animals. Exp. Anim. 2020.
- Mota-Rojas, D.; Napolitano, F.; Braghieri, A.; Guerrero-Legarreta, I.; Bertoni, A.; Martínez-Burnes, J.; Cruz-Monterrosa, R.; Gómez, J.; Ramírez-Bribiesca, E.; Barrios-García, H.; et al. Thermal Biology in River Buffalo in the Humid Tropics: Neurophysiological and Behavioral Responses Assessed by Infrared Thermography. J. Anim. Behav. Biometeorol. 2021, 9.
- Martello, L.S.; da Luz e Silva, S.; da Costa Gomes, R.; da Silva Corte, R.R.P.; Leme, P.R. Infrared Thermography as a Tool to Evaluate Body Surface Temperature and Its Relationship with Feed Efficiency in Bos Indicus Cattle in Tropical Conditions. Int. J. Biometeorol. 2016, 60, 173–181.
- Thompson, S.; Schaefer, A.L.; Crow, G.H.; Basarab, J.; Colyn, J.; Ominski, K. Relationship between Residual Feed Intake and Radiated Heat Loss Using Infrared Thermography in Young Beef Bulls. J. Therm. Biol. 2018, 78, 304–311.
- Ootsuka, Y.; Tanaka, M. Control of Cutaneous Blood Flow by Central Nervous System. Temperature 2015, 2, 392–405.
- Vainionpää, M. Thermographic Imaging in Cats and Dogs Usability as a Clinical Method. Ph.D. Thesis, University of Helsinki, Helsinki, Finland, 2014.
- Lim, S.; Honek, J.; Xue, Y.; Seki, T.; Cao, Z.; Andersson, P.; Yang, X.; Hosaka, K.; Cao, Y. Cold-Induced Activation of Brown Adipose Tissue and Adipose Angiogenesis in Mice. Nat. Protoc. 2012, 7, 606–615.
- Gordon, C.J.; Aydin, C.; Repasky, E.A.; Kokolus, K.M.; Dheyongera, G.; Johnstone, A.F.M. Behaviorally Mediated, Warm Adaptation: A Physiological Strategy When Mice Behaviorally Thermoregulate. J. Therm. Biol. 2014, 44, 41–46.
- Barros, D.V.; Silva, L.K.X.; Kahwage, P.R.; Lourenço Júnior, J.B.; Sousa, J.S.; Silva, A.G.M.; Franco, I.M.; Martorano, L.G.; Garcia, A.R. Assessment of Surface Temperatures of Buffalo Bulls (Bubalus bubalis) Raised under Tropical Conditions Using Infrared Thermography. Arq. Bras. Med. Vet. Zootec. 2016, 68, 422–430.
- Talukder, S.; Thomson, P.C.; Kerrisk, K.L.; Clark, C.E.F.; Celi, P. Evaluation of Infrared Thermography Body Temperature and Collar-Mounted Accelerometer and Acoustic Technology for Predicting Time of Ovulation of Cows in a Pasture-Based System. Theriogenology 2015, 83, 739–748.
- Bertoni, A.; Mota-Rojas, D.; Álvarez-Macias, A.; Mora-Medina, P.; Guerrero-Legarreta, I.; Morales-Canela, A.; Gómez-Prado, J.; José-Pérez, N.; Martínez-Burnes, J. Scientific Findings Related to Changes in Vascular Microcirculation Using Infrared Thermography in the River Buffalo. J. Anim. Behav. Biometeorol. 2020, 8, 288–297.
- Mota-Rojas, D.; Habeeb, A.A.; Napolitano, F.; Sarubbi, J.; Ghezzi, M.; Ceriani, M.C.; Cuibus, A.; Martínez-Burnes, J.; Braghieri, A.; Lendez, P.A.; et al. River Buffalo, European Cattle and Indian Cattle Welfare: Environmental, Physiological and Behavioral Aspects in Response to Natural and Artificial Shade. In El búfalo de Agua en Latinoamérica, Hallazgos Recientes; Napolitano, F., Mota-Rojas, D., Guerrero-Legarreta, J., Orihuela, A., Eds.; BM Editores: Mexico City, Mexico, 2020; pp. 960–1016. Available online: https://www.lifescienceglobal.com/journals/journal-of-buffalo-science/97-abstract/jbs/4550-el-bufalo-de-agua-en-latinoamerica-hallazgos-recientes (accessed on 11 December 2020).
- Nääs, I.A.; Garcia, R.G.; Caldara, F.R. Infrared Thermal Image for Assessing Animal Health and Welfare. J. Anim. Behav. Biometeorol. 2014, 2, 66–72.
- Gigantesco, A.; Giuliani, M. Quality of Life in Mental Health Services with a Focus on Psychiatric Rehabilitation Practice. Ann. Ist. Super Sanità 2011, 47, 363–372.
- International Committee on Veterinary Gross Anatomical Nomenclature. Nomina Anatomica Veterinaria; World Association of Veterinary Anatomist: Oslo, Norway, 2017.
- Constantinescu, M.G. Illustrated Veterinary Anatomical Nomenclature, 4th ed.; Georg Thieme Verlag: Stuttgart, Germany, 2018; pp. 1–576.
- Childs, C. Body temperature and clinical thermometry. In Thermoregulation: From Basic Neuroscience to Clinical Neurology, Part II; Romanovsky, A.A., Ed.; Elsevier Press: Amsterdam, The Netherlands, 2018; pp. 467–482.
- Romanovsky, A.A. Thermoregulation: Some Concepts Have Changed. Functional Architecture of the Thermoregulatory System. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2007, 292, R37–R46.
- Romanovsky, A.A. Skin Temperature: Its Role in Thermoregulation. Acta Physiol. 2014, 210, 498–507.
- Mota-Rojas, D.; Habeeb, A.A.; Ghezzi, M.D.; Kanth Reddy, R.; Napolitano, F.; Lendez, P.A.; Cuibus, A.; Ceriani, C.M.; Sarubbi, J.; Braghieri, A.; et al. Termorragulación del búfalo de agua: Mecanismos neurobiológicos, cambios microcirculatorios y aplicaciones prácticas de la termografía infrarroja. In El Búfalo de Agua en Latinoamérica, Hallazgos Recientes; Napolitano, F., Mota Rojas, D., Guerrero-Legarreta, I., Orihuela, A., Eds.; BM Editores: Mexico City, Mexico, 2020; pp. 922–934.
- Osaka, T. Hypoxia-Induced Hypothermia Mediated by GABA in the Rostral Parapyramidal Area of the Medulla Oblongata. Neuroscience 2014, 267, 46–56.
- Cerri, M.; Zamboni, G.; Tupone, D.; Dentico, D.; Luppi, M.; Martelli, D.; Perez, E.; Amici, R. Cutaneous Vasodilation Elicited by Disinhibition of the Caudal Portion of the Rostral Ventromedial Medulla of the Free-Behaving Rat. Neuroscience 2010, 165, 984–995.
- Labeur, L.; Villiers, G.; Small, A.H.; Hinch, G.N.; Schmoelzl, S. Infrared Thermal Imaging as a Method to Evaluate Heat Loss in Newborn Lambs. Res. Vet. Sci. 2017, 115, 517–522.
- Morrison, S.F.; Nakamura, K. Central Mechanisms for Thermoregulation. Annu. Rev. Physiol. 2019, 81, 285–308.
- Jia, G.; Li, W.; Meng, J.; Tan, H.; Feng, Y. Non-Contact Evaluation of Pigs’ Body Temperature Incorporating Environmental Factors. Sensors 2020, 20, 4282.
- Vainionpää, M.; Tienhaara, E.-P.; Raekallio, M.; Junnila, J.; Snellman, M.; Vainio, O. Thermographic Imaging of the Superficial Temperature in Racing Greyhounds before and after the Race. Sci. World J. 2012, 2012, 1–6.
- Xu, Z.; Agbigbe, O.; Nigro, N.; Yakobi, G.; Shapiro, J.; Ginosar, Y. Use of High-Resolution Thermography as a Validation Measure to Confirm Epidural Anesthesia in Mice: A Cross-over Study. Int. J. Obstet. Anesth. 2021, 46, 102981.
- Küls, N.; Blissitt, K.J.; Shaw, D.J.; Schöffmann, G.; Clutton, R.E. Thermography as an Early Predictive Measurement for Evaluating Epidural and Femoral–Sciatic Block Success in Dogs. Vet. Anaesth. Anal. 2017, 44, 1198–1207.
- Church, J.S.; Hegadoren, P.R.; Paetkau, M.J.; Miller, C.C.; Regev-Shoshani, G.; Schaefer, A.L.; Schwartzkopf-Genswein, K.S. Influence of Environmental Factors on Infrared Eye Temperature Measurements in Cattle. Res. Vet. Sci. 2014, 96, 220–226.
- Idris, M.; Uddin, J.; Sullivan, M.; McNeill, D.M.; Phillips, C.J.C. Non-Invasive Physiological Indicators of Heat Stress in Cattle. Animals 2021, 11, 71.
- Montanholi, Y.R.; Odongo, N.E.; Swanson, K.C.; Schenkel, F.S.; McBride, B.W.; Miller, S.P. Application of Infrared Thermography as an Indicator of Heat and Methane Production and Its Use in the Study of Skin Temperature in Response to Physiological Events in Dairy Cattle (Bos Taurus). J. Therm. Biol. 2008, 33, 468–475.
- Perez Marquez, H.J.; Ambrose, D.J.; Schaefer, A.L.; Cook, N.J.; Bench, C.J. Infrared Thermography and Behavioral Biometrics Associated with Estrus Indicators and Ovulation in Estrus-Synchronized Dairy Cows Housed in Tiestalls. J. Dairy Sci. 2019, 102, 4427–4440.
- Huggins, J.; Rakobowchuk, M. Utility of Lacrimal Caruncle Infrared Thermography When Monitoring Alterations in Autonomic Activity in Healthy Humans. Eur. J. Appl. Physiol. 2019, 119, 531–538.
- Stewart, M.; Stookey, J.M.; Stafford, K.J.; Tucker, C.B.; Rogers, A.R.; Dowling, S.K.; Verkerk, G.A.; Schaefer, A.L.; Webster, J.R. Effects of Local Anesthetic and a Nonsteroidal Antiinflammatory Drug on Pain Responses of Dairy Calves to Hot-Iron Dehorning. J. Dairy Sci. 2009.
- Stewart, M.; Verkerk, G.A.; Stafford, K.J.; Schaefer, A.L.; Webster, J.R. Noninvasive Assessment of Autonomic Activity for Evaluation of Pain in Calves, Using Surgical Castration as a Model. J. Dairy Sci. 2010, 93, 3602–3609.
- Giro, A.; de Campos Bernardi, A.C.; Barioni Junior, W.; Lemes, A.P.; Botta, D.; Romanello, N.; do Nascimento Barreto, A.; Garcia, A.R. Application of Microchip and Infrared Thermography for Monitoring Body Temperature of Beef Cattle Kept on Pasture. J. Therm. Biol. 2019, 84, 121–128.
- Stewart, M.; Stafford, K.J.; Dowling, S.K.; Schaefer, A.L.; Webster, J.R. Eye Temperature and Heart Rate Variability of Calves Disbudded with or without Local Anaesthetic. Physiol. Behav. 2008, 93, 789–797.
- Sprecher, D.J.; Hostetler, D.E.; Kaneene, J.B. A Lameness Scoring System That Uses Posture and Gait to Predict Dairy Cattle Reproductive Performance. Theriogenology 1997, 47, 1179–1187.
- Lowe, G.; McCane, B.; Sutherland, M.; Waas, J.; Schaefer, A.; Cox, N.; Stewart, M. Automated Collection and Analysis of Infrared Thermograms for Measuring Eye and Cheek Temperatures in Calves. Animals 2020, 10, 292.
- Chikkagoudara, K.P.; Singh, P.; Barman, D.; Potshangbam, C.; Bhatt, N.; Singh, S.V.; Lathwal, S.S. Eye Temperature, an Indicator for Stress Levels in Young Buffalo Bulls—A Case Study of Micro-Environment Modification. J. Agrometeorol. 2020, 22, 266–273.
- Scoley, G.E.; Gordon, A.W.; Morrison, S.J. Use of Thermal Imaging in Dairy Calves: Exploring the Repeatability and Accuracy of Measures Taken from Different Anatomical Regions1. Trans. Anim. Sci. 2019, 3, 564–576.
- Athaíde, L.G.; Joset, W.C.; de Almeida, J.F.; Pantoja, M.H.; Noronha, R.D.; Bezerra, A.S.; Barbosa, A.V.; Martorano, L.G.; da Silva, J.A.; Lourenço Júnior, J.D. Thermoregulatory and Behavioral Responses of Buffaloes With and Without Direct Sun Exposure During Abnormal Environmental Condition in Marajó Island, Pará, Brazil. Front. Vet. Sci. 2020, 7, 1–10.
- Brcko, C.C.; Silva, J.A.; Martorano, L.G.; Vilela, R.A.; Nahúm, B.D.; Silva, A.G.; Barbosa, A.V.; Bezerra, A.S.; Lourenço Júnior, J.D. Infrared Thermography to Assess Thermoregulatory Reactions of Female Buffaloes in a Humid Tropical Environment. Front. Vet. Sci. 2020, 7, 180.
- Bleul, U.; Hässig, M.; Kluser, F. Screening of Febrile Cows Using a Small Handheld Infrared Thermography Device. Tierarztl. Prax. Ausg. G Grosstiere/Nutztiere 2021, 49, 12–20.
- Seixas, A.; Ammer, K. Utility of Infrared Thermography When Monitoring Autonomic Activity. Eur. J. Appl. Physiol. 2019, 119, 1455–1457.
- Sutherland, M.A.; Worth, G.M.; Dowling, S.K.; Lowe, G.L.; Cave, V.M.; Stewart, M. Evaluation of Infrared Thermography as a Non-Invasive Method of Measuring the Autonomic Nervous Response in Sheep. PLoS ONE 2020, 15, e0233558.
- Jansson, A.; Lindgren, G.; Velie, B.D.; Solé, M. An Investigation into Factors Influencing Basal Eye Temperature in the Domestic Horse (Equus Caballus) When Measured Using Infrared Thermography in Field Conditions. Physiol. Behav. 2021, 228.
- Strutzke, S.; Fiske, D.; Hoffmann, G.; Ammon, C.; Heuwieser, W.; Amon, T. Technical Note: Development of a Noninvasive Respiration Rate Sensor for Cattle. J. Dairy Sci. 2019, 102, 690–695.
- Marques da Silva, D.C. Termografia Infravermelho e Medidas de Eficiência de Bubalinos de Três Grupos Genéticos Sob Condições Tropicais. Ph.D. Thesis, Universidade Estadual Paulista, Botucatu, Brasil, 2019.
- Abbas, A.K.; Heimann, K.; Jergus, K.; Orlikowsky, T.; Leonhardt, S. Neonatal Non-Contact Respiratory Monitoring Based on Real-Time Infrared Thermography. Biomed. Eng. Online 2011, 10, 93.
- Machado, N.A.F.; Da Costa, L.B.S.; Barbosa-Filho, J.A.D.; De Oliveira, K.P.L.; De Sampaio, L.C.; Peixoto, M.S.M.; Damasceno, F.A. Using Infrared Thermography to Detect Subclinical Mastitis in Dairy Cows in Compost Barn Systems. J. Therm. Biol. 2021, 97, 102881.
- Sarubbi, F.; Grazioli, G.; Auriemma, G. A Potential Application of Infrared Thermography ( IRT ) in Mediterranean A Potential Application of Infrared Thermography ( IRT ) in Mediterranean Lactating Buffalo. Asian Basic Appl. Res. J. 2020, 2, 11–16.
- Fox, L.K.; Gay, J.M. Contagious Mastitis. Vet. Clin. N. Am. Food Anim. Pract. 1993, 9, 475–487.
- Hovinen, M.; Siivonen, J.; Taponen, S.; Hänninen, L.; Pastell, M.; Aisla, A.-M.; Pyörälä, S. Detection of Clinical Mastitis with the Help of a Thermal Camera. J. Dairy Sci. 2008, 91, 4592–4598.
- Polat, B.; Colak, A.; Cengiz, M.; Yanmaz, L.E.; Oral, H.; Bastan, A.; Kaya, S.; Hayirli, A. Sensitivity and Specificity of Infrared Thermography in Detection of Subclinical Mastitis in Dairy Cows. J. Dairy Sci. 2010, 93, 3525–3532.
- Olmos-Hernández, A.; Ghezzi, M.D.; Napolitano, F.; Cuibus, A.; Álvarez-Macías, A.; Braghieri, A.; Mota-Rojas, D. Anatomophysiology of the mammary gland: Neuroendocrinology of milk ejection in the river buffalo. In El Búfalo de Agua en Latinoamérica, Hallazgos Recientes; Napolitano, F., Mota-Rojas, D., Guerrero-Legarreta, I., Orihuela, A., Eds.; BM Editores: Mexico City, Mexico, 2020; pp. 721–771.
- Budras, K.D.; Habel, R.E. Bovine Anatomy an Illustrated Text, 1st ed.; Schulutersche: Hanover, Germany, 2003; pp. 1–440.
- Radigonda, V.L.; Pereira, G.R.; da Cruz Favaro, P.; Barca Júnior, F.A.; Borges, M.H.F.; Galdioli, V.H.G.; Júnior, C.K. Infrared Thermography Relationship between the Temperature of the Vulvar Skin, Ovarian Activity, and Pregnancy Rates in Braford Cows. Trop. Anim. Health Prod. 2017, 49, 1787–1791.
- de Ruediger, F.R.; Yamada, P.H.; Bicas Barbosa, L.G.; Mungai Chacur, M.G.; Pinheiro Ferreira, J.C.; de Carvalho, N.A.T.; Milani Soriano, G.A.; Codognoto, V.M.; Oba, E. Effect of Estrous Cycle Phase on Vulvar, Orbital Area and Muzzle Surface Temperatures as Determined Using Digital Infrared Thermography in Buffalo. Anim. Reprod. Sci. 2018, 197, 154–161.
- McManus, C.; Tanure, C.B.; Peripolli, V.; Seixas, L.; Fischer, V.; Gabbi, A.M.; Menegassi, S.R.O.; Stumpf, M.T.; Kolling, G.J.; Dias, E.; et al. Infrared Thermography in Animal Production: An Overview. Comput. Electron. Agric. 2016, 123, 10–16.
- Yadav, S.K.; Singh, P.; Kumar, P.; Singh, S.V.; Singh, A.; Kumar, S. Scrotal Infrared Thermography and Testicular Biometry: Indicator of Semen Quality in Murrah Buffalo Bulls. Anim. Reprod. Sci. 2019, 209, 106145.
- Chacur, M.G.M. Termografia Por Infravermelho Na Reprodução de Bubalinos. Rev. Bras. Reprod. Anim. 2017, 41, 180–187.
- Gianesella, M.; Arfuso, F.; Fiore, E.; Giambelluca, S.; Giudice, E.; Armato, L.; Piccione, G. Infrared Thermography as a Rapid and Non-Invasive Diagnostic Tool to Detect Inflammatory Foot Diseases in Dairy Cows. Pol. J. Vet. Sci. 2018, 21, 299–305.
- Hernandez-Mendo, O.; von Keyserlingk, M.A.G.; Veira, D.M.; Weary, D.M. Effects of Pasture on Lameness in Dairy Cows. J. Dairy Sci. 2007, 90, 1209–1214.
- LokeshBabu, D.S.; Jeyakumar, S.; Vasant, P.J.; Sathiyabarathi, M.; Manimaran, A.; Kumaresan, A.; Pushpadass, H.A.; Sivaram, M.; Ramesha, K.P.; Kataktalware, M.A.; et al. Monitoring Foot Surface Temperature Using Infrared Thermal Imaging for Assessment of Hoof Health Status in Cattle: A Review. J. Therm. Biol. 2018, 78, 10–21.
- Stokes, J.E.; Leach, K.A.; Main, D.C.J.; Whay, H.R. An Investigation into the Use of Infrared Thermography (IRT) as a Rapid Diagnostic Tool for Foot Lesions in Dairy Cattle. Vet. J. 2012, 193, 674–678.
- Orman, A.; Endres, M.I. Use of Thermal Imaging for Identification of Foot Lesions in Dairy Cattle. Act. Agric. Scand. A Anim. Sci. 2016, 66, 1–7.
- Alsaaod, M.; Büscher, W. Detection of Hoof Lesions Using Digital Infrared Thermography in Dairy Cows. J. Dairy Sci. 2012, 95, 735–742.
- Bleul, U.; Hässig, M.; Kluser, F. Screening of Febrile Cows Using Infrared Thermography. Tierarztliche Praxis Ausgabe G Grosstiere Nutztiere 2019, 49, 12–20.
- Metzner, M.; Sauter-Louis, C.; Seemueller, A.; Petzl, W.; Klee, W. Infrared Thermography of the Udder Surface of Dairy Cattle: Characteristics, Methods, and Correlation with Rectal Temperature. Vet. J. 2014, 199, 57–62.
- Schaefer, A.L.; Cook, N.J.; Bench, C.; Chabot, J.B.; Colyn, J.; Liu, T.; Okine, E.K.; Stewart, M.; Webster, J.R. The Non-Invasive and Automated Detection of Bovine Respiratory Disease Onset in Receiver Calves Using Infrared Thermography. Res. Vet. Sci. 2012, 93, 928–935.
- Mota-Rojas, D.; Wang, D.; Gonçalves Titto, C.; Gómez-Prado, J.; Carvajal-de la Fuenta, V.; Ghezzi, M.; Boscato-Funes, L.; Barrios-García, H.; Torres-Bernal, F.; Casas-Alvarado, A.; et al. Pathophysiology of fever and application of infrared thermography (IRT) in the detection of sick domestic animals: Recent advances. Animals 2021. in revision.
- Fernández-Cuevas, I.; Bouzas Marins, J.C.; Arnáiz Lastras, J.; Gómez Carmona, P.M.; Piñonosa Cano, S.; García-Concepción, M.Á.; Sillero-Quintana, M. Classification of Factors Influencing the Use of Infrared Thermography in Humans: A Review. Infrared Phys. Technol. 2015, 71, 28–55.
This entry is offline, you can click here to edit this entry!
