Debido a su similitud estructural con los α-aminoácidos naturales, los derivados del ácido α-aminofosfónico son moléculas biológicamente activas conocidas. En vista de la relevancia de los carbonos tetrasustituidos en la naturaleza y la medicina y la fuerte dependencia de la actividad biológica de las moléculas quirales en su configuración absoluta, la síntesis de α-aminofosfonatos que llevan carbonos tetrasustituidos de manera asimétrica ha ganado interés en las últimas décadas. . En las siguientes líneas, se resume la bibliografía existente para la síntesis de α-aminofosfonatos tetrasustituidos ópticamente activos, que comprenden enfoques diastereoselectivos y enantioselectivos.
- asymmetric synthesis
- α-aminophosphonic acid
- tetrasubstituted carbons
- diastereoselective
1. Introducción
Los α-aminoácidos son una estructura clave en los organismos vivos como parte esencial de proteínas y péptidos. Muchos derivados de α-aminoácidos se utilizan en la vida diaria, como el edulcorante aspartamo, antibióticos derivados de la penicilina o enalapril antihipertensivo. Debido a la relevancia de los α-aminoácidos en la naturaleza, se han desarrollado una gran cantidad de métodos para la síntesis de α-aminoácidos naturales y no naturales [ 1 ] [ 2 ] [ 3 ] . Dentro de los miméticos de α-aminoácidos más relevantes, los ácidos α-aminofosfónicos son el resultado de una sustitución bioisostérica del ácido carboxílico plano por un grupo de ácido fosfónico en las estructuras de α-aminoácidos ( Figura 1 ).
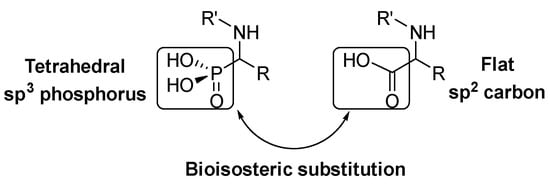
Figura 1. Analogía estructural de α-aminoácidos y ácidos α-aminofosfónicos.
Esta sustitución isostérica es de gran interés ya que, debido a la configuración tetraédrica del átomo de fósforo, los derivados del ácido α-aminofosfónico pueden comportarse como análogos estables del estado de transición para la escisión de péptidos, inhibiendo así las enzimas involucradas en los procesos de proteólisis y, en consecuencia, presentan una variedad de actividades biológicas [ 4 ] [ 5 ] [ 6 ] [ 7 ] . En particular, varios derivados del ácido α-aminofosfónico han encontrado aplicaciones como agroquímicos [ 8 ] [ 9 ] , así como antimicrobianos [ 10 ] [ 11] [ 12 ] , antioxidantes [ 13 ] [ 14 ] [ 15 ] o agentes anticancerígenos ( Figura 2 ) [ 16 ] [ 17 ] [ 18 ] .
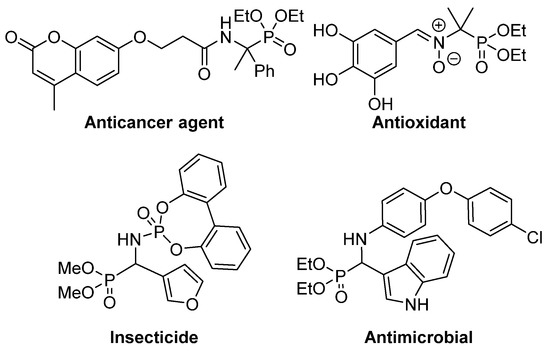
Figura 2. Algunos ejemplos de derivados del ácido α-aminofosfónico biológicamente activos.
El desastre de la talidomida fue una sorprendente revelación de la fuerte dependencia de la actividad biológica de los sustratos quirales en su configuración absoluta. Esta dependencia también es evidente para los derivados del ácido α-aminofosfónico y, como ejemplos, la ( R ) -fosfoleucina exhibe una actividad más fuerte como inhibidor de leucina-peptidasa que su enantiómero ( Figura 3 ) [ 19 ] [ 20 ] , y el fosfopéptido ( S ) , ( R ) -alafosfalina tiene una actividad antibiótica más eficiente que sus otros tres posibles isómeros [ 21 ] [ 22 ] .
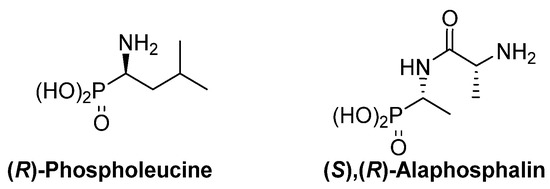
Figura 3. Isómeros más activos de fosfoleucina y alafosfalina.
Los ácidos α-aminofosfónicos se obtienen habitualmente a partir de la hidrólisis de sus ésteres de fosfonato y, por ello, el desarrollo de metodologías sintéticas eficientes para acceder a α-aminofosfonatos enantioenriquecidos se ha convertido en una tarea imperativa en la química orgánica. La literatura existente hasta la fecha en este campo está relacionada principalmente con la síntesis de α-aminofosfonatos trisustituidos y los ejemplos que ilustran estrategias asimétricas que conducen a la formación de sustratos tetrasustituidos son escasos [ 23 ] [ 24 ] . La formación eficiente de centros cuaternarios se conoce como un desafío crítico en la síntesis orgánica [ 25 ] [ 26 ] [ 27 ]y la formación de centros tetrasustituidos a partir de cetiminas fue durante mucho tiempo inalcanzable. El carácter electrófilo deficiente del grupo cetimina y el obstáculo estérico adicional en el sustrato que da como resultado una reactividad disminuida son los dos desafíos principales a superar. Además, las caras enantiotópicas de los sustratos de cetimina no se discriminan tan fácilmente como las de las aldiminas si se requieren síntesis asimétricas [ 28 ] .
Los métodos existentes para la síntesis de α-aminofosfonatos tetrasustituidos se pueden clasificar en tres grupos principales, dependiendo del tipo de enlace creado en la reacción clave que conduce a su formación ( Figura 4 ). El primero de esos enfoques implica el uso de estrategias que implican la formación de enlaces CC, ya sea mediante la adición de nucleófilos de carbono a iminas α-fosforiladas ( Figura 4 a) o funcionalización de aniones α-aminofosfonatos con electrófilos ( Figura 4 b). Además, el método más sencillo para la síntesis de α-aminofosfonatos comprende reacciones que implican la formación de enlaces CP mediante la adición de nucleófilos de fósforo a cetiminas ( Figura 4C). Otra alternativa a estas rutas consiste en procesos que involucran la formación de enlaces CN, que se llevan a cabo principalmente a través de reacciones de aminación electrofílica ( Figura 4 d).
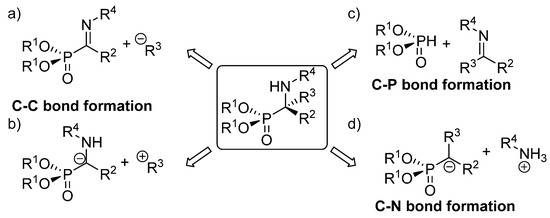
Figura 4. Enfoques sintéticos asimétricos para α-aminofosfonatos tetrasustituidos: ( a ) adición de nucleófilos a iminas fosforiladas; ( b ) adición de α aminofosfonatos a electrófilos; ( c ) hidrofosfonilación de iminas; ( d ) aminación electrofílica.
En las siguientes líneas de esta revisión se resumen las metodologías existentes con respecto a la síntesis asimétrica de α-aminofosfonatos tetrasustituidos. Las rutas sintéticas para la preparación de estos compuestos se clasifican en metodologías diastereoselectivas y enantioselectivas y se agrupan por el tipo de enlace formado en el paso clave.
2. Observaciones finales
Aunque se han informado algunos ejemplos de síntesis estereocontrolada de α-aminofosfonatos tetrasustituidos, todavía son bastante limitados si se comparan con las reacciones homólogas para la preparación de α-aminofosfonatos trisustituidos. En particular, durante los últimos años, los principales esfuerzos se han centrado en las transformaciones enantioselectivas, que se sabe que son más atractivas que las diastereoselectivas. Cabe señalar que la mayoría de las reacciones enantioselectivas resumidas en esta revisión se han publicado durante la última década y, por lo tanto, se esperan más artículos relacionados en los próximos años.
Uno de los temas más prometedores está relacionado con las adiciones nucleofílicas a cetiminas α-fosforiladas, que han experimentado un importante crecimiento durante el último lustro. Otro tema prometedor es la adición enantioselectiva de nucleófilos de fósforo a cetiminas. Ha sido poco explorado, con solo algunos ejemplos reportados hasta la fecha pero, debido a la gran cantidad de protocolos sintéticos para la preparación de iminas conocidos en la literatura, el desarrollo de nuevos protocolos enantioselectivos para esta transformación representaría una mejora relevante para ampliar la diversidad estructural de los α-aminofosfonatos tetrasustituidos.
This entry is adapted from the peer-reviewed paper 10.3390/molecules26113202
References
- Duthaler, R.O. Recent developments in the stereoselective synthesis of α-aminoacids. Tetrahedron 1994, 50, 1539–1650.
- Nájera, C.; Sansano, J.M. Catalytic asymmetric synthesis of α-amino acids. Chem. Rev. 2007, 107, 4584–4671.
- O’Donnell, M.J. The enantioselective synthesis of α-amino acids by phase-transfer catalysis with achiral Schiff base esters. Acc. Chem. Res. 2004, 37, 506–517.
- Berlicki, L.; Kafarski, P. Computer-Aided Analysis and Design of Phosphonic and Phosphinic Enzyme Inhibitors as Potential Drugs and Agrochemicals. Curr. Org. Chem. 2005, 9, 1829–1850.
- Sieńczyk, M.; Winiarski, Ł.; Kasperkiewicz, P.; Psurski, M.; Wietrzyk, J.; Oleksyszyn, J. Simple phosphonic inhibitors of human neutrophil elastase. Bioorg. Med. Chem. Lett. 2011, 21, 1310–1314.
- Vassiliou, S.; Węglarz-Tomczak, E.; Berlicki, Ł.; Pawełczak, M.; Nocek, B.; Mulligan, R.; Joachimiak, A.; Mucha, A. Structure-guided, single-point modifications in the phosphinic dipeptide structure yield highly potent and selective inhibitors of neutral aminopeptidases. J. Med. Chem. 2014, 57, 8140–8151.
- Arya, T.; Reddi, R.; Kishor, C.; Ganji, R.J.; Bhukya, S.; Gumpena, R.; McGowan, S.; Drag, M.; Addlagatta, A. Identification of the molecular basis of inhibitor selectivity between the human and streptococcal type i methionine aminopeptidases. J. Med. Chem. 2015, 58, 2350–2357.
- Veera Narayana Reddy, M.; Balakrishna, A.; Anil Kumar, M.; Chandra Sekhar Reddy, G.; Uma Ravi Sankar, A.; Suresh Reddy, C.; Murali Krishna, T. One-step synthesis and bioassay of N-phosphoramidophosphonates. Chem. Pharm. Bull. 2009, 57, 1391–1395.
- Che, J.Y.; Xu, X.Y.; Tang, Z.L.; Gu, Y.C.; Shi, D.Q. Synthesis and herbicidal activity evaluation of novel α-amino phosphonate derivatives containing a uracil moiety. Bioorg. Med. Chem. Lett. 2016, 26, 1310–1313.
- Narayana Reddy, M.V.; Siva Kumar, B.; Balakrishna, A.; Reddy, C.S.; Nayak, S.K.; Reddya, C.D. One-pot synthesis of novel α-amino phosphonates using tetramethylguanidine as a catalyst. Arkivoc 2007, 2007, 246–254.
- Dake, S.A.; Raut, D.S.; Kharat, K.R.; Mhaske, R.S.; Deshmukh, S.U.; Pawar, R.P. Ionic liquid promoted synthesis, antibacterial and in vitro antiproliferative activity of novel α-aminophosphonate derivatives. Bioorg. Med. Chem. Lett. 2011, 21, 2527–2532.
- Sivala, M.R.; Devineni, S.R.; Golla, M.; Medarametla, V.; Pothuru, G.K.; Chamarthi, N.R. A heterogeneous catalyst, SiO2-ZnBr2: An efficient neat access for α-aminophosphonates and antimicrobial activity evaluation. J. Chem. Sci. 2016, 128, 1303–1313.
- Rao, K.U.M.; Swapna, S.; Manidhar, D.M.; Reddy, K.M.K.; Reddy, C.S. Efficient synthesis of α-aminophosphonates and evaluation of significance of PO group towards antioxidant activity. Phosphorus Sulfur Silicon Relat. Elem. 2015, 190, 232–239.
- Cassien, M.; Petrocchi, C.; Thétiot-Laurent, S.; Robin, M.; Ricquebourg, E.; Kandouli, C.; Asteian, A.; Rockenbauer, A.; Mercier, A.; Culcasi, M.; et al. On the vasoprotective mechanisms underlying novel β-phosphorylated nitrones: Focus on free radical characterization, scavenging and NO-donation in a biological model of oxidative stress. Eur. J. Med. Chem. 2016, 119, 197–217.
- Damiche, R.; Chafaa, S. Synthesis of new bioactive aminophosphonates and study of their antioxidant, anti-inflammatory and antibacterial activities as well the assessment of their toxicological activity. J. Mol. Struct. 2017, 1130, 1009–1017.
- Li, Y.J.; Wang, C.Y.; Ye, M.Y.; Yao, G.Y.; Wang, H.S. Novel coumarin-containing aminophosphonatesas antitumor agent: Synthesis, cytotoxicity, DNA-Binding and apoptosis evaluation. Molecules 2015, 20, 14791–14809.
- Huang, R.Z.; Wang, C.Y.; Li, J.F.; Yao, G.Y.; Pan, Y.M.; Ye, M.Y.; Wang, H.S.; Zhang, Y. Synthesis, antiproliferative and apoptosis-inducing effects of novel asiatic acid derivatives containing α-aminophosphonates. RSC Adv. 2016, 6, 62890–62906.
- Wang, Q.; Yang, L.; Ding, H.; Chen, X.; Wang, H.; Tang, X. Synthesis, X-ray crystal structure, DNA/protein binding and cytotoxicity studies of five α-aminophosphonate N-derivatives. Bioorg. Chem. 2016, 69, 132–139.
- Stamper, C.; Bennett, B.; Edwards, T.; Holz, R.C.; Ringe, D.; Petsko, G. Inhibition of the aminopeptidase from Aeromonas proteolytica by l-leucinephosphonic acid. Spectroscopic and crystallographic characterization of the transition state of peptide hydrolysis. Biochemistry 2001, 40, 7035–7046.
- Kafarski, P.; Lejczak, B.; Szewczyk, J. Optically active 1-aminoalkanephosphonic acids. Dibenzoyl-l-tartaric anhydride as an effective agent for the resolution of racemic diphenyl 1-aminoalkanephosphonates. Can. J. Chem. 1983, 61, 2425–2430.
- Solodenko, V.A.; Kukhar, V.P. Stereoselective papain-catalyzed Synthesis of Alafosfalin. Tetrahedron Lett. 1989, 30, 6917–6918.
- Poliak, M.S. Antibiotics of the phosphonic acid group. Antibiot. Med Biotechnol. 1987, 32, 66–75.
- Ordóñez, M.; Sayago, F.J.; Cativiela, C. Synthesis of quaternary α-aminophosphonic acids. Tetrahedron 2012, 68, 6369–6412.
- Bera, K.; Namboothiri, I.N.N. Asymmetric Synthesis of Quaternary α-Amino Acids and Their Phosphonate Analogues. Asian J. Org. Chem. 2014, 3, 1234–1260.
- Shimizu, M. Construction of asymmetric quaternary carbon centers with high enantioselectivity. Angew. Chem. Int. Ed. 2011, 50, 5998–6000.
- Hawner, C.; Alexakis, A. Metal-catalyzed asymmetric conjugate addition reaction: Formation of quaternary stereocenters. Chem. Commun. 2010, 46, 7295–7306.
- Christoffers, J.; Baro, A. Quaternary Stereocenters: Challenges and Solutions for Organic Synthesis; John Wiley & Sons: Hoboken, NJ, USA, 2006; ISBN 3527311076.
- Riant, O.; Hannedouche, J. Asymmetric catalysis for the construction of quaternary carbon centres: Nucleophilic addition on ketones and ketimines. Org. Biomol. Chem. 2007, 5, 873–888.
