Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Medicine, General & Internal
Профилактические и лечебные свойства полифенольных соединений растений известны давно. В качестве активных ингредиентов они используются для профилактики и лечения многих неинфекционных заболеваний. В последние десятилетия морские макроводоросли привлекли внимание биотехнологов и фармакологов как многообещающий и почти неисчерпаемый источник полифенолов. Эта гетерогенная группа соединений содержит множество биополимеров с уникальной структурой и биологическими свойствами, которые обладают высокой противоинфекционной активностью.
- Polyphenolic Compounds of Seaweed
1. Введение
Высокая вирулентность новых и повторяющихся вирусов и отсутствие эффективных методов лечения вызываемых ими заболеваний создают серьезную проблему для систем общественного здравоохранения. Разработка высокоэффективных противовирусных препаратов широкого спектра действия с низкой токсичностью и невысокой стоимостью уже много лет является одной из основных проблем вирусологии и фармацевтики. В период продолжающейся пандемии COVID-19 он приобрел особую актуальность и важность и направлен на создание агентов, которые подавляют проникновение и репликацию вируса, одновременно регулируя защитные системы организма.
Процесс размножения вируса включает три фазы [ 1 ]. Первый - это адсорбция и проникновение вируса в клетку, высвобождение его внутренних структурных компонентов и модификация до состояния, при котором он может вызвать инфекционный процесс. Присоединение вируса к клеткам-хозяевам макроорганизма представляет собой специфическое взаимодействие между поверхностными белками вируса и рецепторами, расположенными на поверхности клеток-хозяев. Вторая фаза воспроизводства регулируется сложными процессами с экспрессией вирусного генома. Наконец, третья стадия размножения - это высвобождение вирусного потомства из клетки-хозяина путем почкования или лизиса.
В настоящее время в медицине имеется большой набор противовирусных средств, способных воздействовать на каждую из этих стадий [ 2 ]. При этом ежегодно наблюдается быстрое увеличение их количества за счет соединений, выделенных из наземных растений. Возможность использования синтетических и растительных препаратов для лечения вирусных заболеваний определяется рядом свойств, таких как терапевтический эффект, отсутствие или минимум побочных реакций, низкая токсичность.
Синтетические противовирусные препараты действуют быстрее и дают, как правило, максимальный терапевтический эффект. Однако их недостаток - большое количество противопоказаний и побочных реакций, а также привыкание и отсутствие желаемого эффекта в будущем. Противовирусные препараты растительного происхождения обладают широким спектром действия (кроме противовирусного, обладают противовоспалительным, антиоксидантным и иммуномодулирующим действием), менее токсичны или нетоксичны в рабочих дозах, имеют минимальные побочные эффекты. Возможно, что фитотерапия может иметь потенциал как профилактическое средство и даже как терапевтическое средство для пациентов с вирусной инфекцией.
Несмотря на определенные успехи в химиотерапии вирусных заболеваний, клиническая практика сталкивается с серьезными проблемами, такими как появление лекарственно-устойчивых вариантов вирусов и побочных эффектов противовирусных препаратов. Это обстоятельство диктует необходимость разработки новых противовирусных препаратов с различными механизмами действия [ 3 , 4 ].
Исследования соединений с противовирусными свойствами, полученных из наземных и морских растений, показали, что из-за их разнообразных механизмов действия (противовирусное, иммуностимулирующее, противовоспалительное и антиоксидантное) вирусы, как правило, не приобретают устойчивости к этим соединениям. Поэтому водные организмы, продуцирующие вещества, которые иногда не встречаются в наземных растениях и обладают чрезвычайно высокой поливалентной биологической активностью, привлекли особое внимание исследователей [ 5 ].
Мировой опыт использования фармацевтических препаратов морского происхождения показывает огромный потенциал морских организмов в качестве сырья для создания оригинальных фармацевтических субстанций и лекарств [ 6 ]. Водоросли, губки, бактерии, грибы, беспозвоночные, мягкие кораллы, рыбы и др. Могут быть источниками новых противовирусных фармакологических соединений морского происхождения [ 7 , 8 , 9 ]. Ряд соединений этих организмов коммерчески доступен на фармацевтическом рынке во всем мире в качестве альтернативы противовирусным препаратам [ 10 ].
2. Общие характеристики полифенольных соединений морских водорослей.
Морские макроводоросли - уникальное сырье для получения широкого спектра природных соединений с интересными и полезными биологическими свойствами. Их состав отличается богатым содержанием минеральных и органических веществ. На протяжении тысячелетий эти гидробионты активно использовались людьми и животными в пищу и служили ценным источником белков, жиров, углеводов, пищевых волокон, минералов и т. Д.
Регулярное употребление водорослей может снизить риск различных патологий, включая рак, метаболические и дегенеративные нарушения, инфекционные и сердечно-сосудистые заболевания. Наибольшей противовирусной активностью, как показали многочисленные экспериментальные исследования, обладают полифенольные соединения и сульфатированные полисахариды. Содержание биологически активных веществ в водорослях варьируется в зависимости от сезона и региона сбора и во многом определяется типом водорослей. По наличию специфических пигментов макроводоросли делятся на три основные группы: коричневые (Phaeophyceae), зеленые (Chlorophyta) и красные (Rhodophyta) водоросли.
Полифенолы (PP) - вторичные метаболиты водорослей с высокой гидрофильностью - являются одной из самых многочисленных групп веществ в царстве растений. Макро- и микроводоросли, а также цианобактерии накапливают ФП, в частности флороглюцин и его полимеры - флоротаннины [ 11 ]. Бромфенолы, фенольные кислоты и флавоноиды составляют наибольшую долю фенольных соединений, содержащихся в красных и зеленых водорослях [ 12 ]. Флоротанины (ФТ) представляют собой гетерогенную группу уникальных полифенольных соединений, различающихся по структуре и степени полимеризации, и встречаются только в бурых морских водорослях (до 25% от сухой массы) [ 13 , 14 ]. Наибольшее количество ФТ накапливается в бурых водорослях фукус [ 15 , 16 ,17 , 18 ]. ПТ состоят из мономерных звеньев флороглюцина (1,3,5-гидроксибензола), из которых было получено более 700 природных вариаций этих соединений, которые используются в различных областях [ 19 ] ( рис. 1 ).
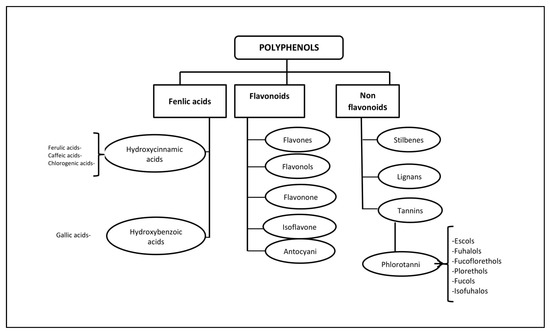
Рисунок 1. Классификация полифенолов и шесть основных подклассов флортанинов морских водорослей.
В отличие от дубильных веществ наземных растений, ПТ имеют более широкий диапазон молекулярных масс - от 126 Да до 650 кДа (чаще от 10 до 100 кДа). Характеристика ПП затруднена из-за неоднородности как по молекулярной массе, так и по уровню изомеризации [ 20 , 21 ]. До сих пор имеется мало информации об эндогенном пищеварении и микробном катаболизме этих соединений [ 22 ]. Известно, что около 90–95% пищевых ФП в неизмененном виде попадают в кишечник [ 23 ], где в результате метаболизма и биотрансформации образуются низкомолекулярные соединения с меньшей химической гетерогенностью, чем в исходном [ 24 ].
Некоторые ФТ в морских водорослях могут быть сульфатированы или галогенированы [ 25 ]. Биосинтез ПТ осуществляется по ацетатно-малонатному пути в аппарате Гольджи в перинуклеарной области клетки. Обычно они не секретируются, и для их получения необходимо разрушение клеток. С точки зрения структуры и полимерных свойств ПТ представляют собой обширную группу молекул, которые различаются по природе связей между флороглюцином и гидроксильными группами ( рис. 1 ). В зависимости от типа связи между мономерами флортаннины делятся на четыре подкласса: флорэтолы и фухалолы, фуколы, фукофлорэтолы, эколы и кармалол [ 26 , 27]. Эти соединения существуют в основном в растворимой форме или в связанном состоянии с компонентами клеточной стенки, которые обеспечивают ее целостность, а также защиту от травоядных животных и окислительного стресса.
Наземные растения производят дубильные вещества, которые состоят только из трех или четырех фенольных колец, в то время как PT морских водорослей состоят из восьми фенольных колец. ФТ обладают очень сильными антиоксидантными свойствами, поскольку фенольные кольца действуют как ловушки электронов для свободных радикалов [ 12 ]. Отмечена положительная корреляция между антиоксидантной активностью ФТ и количеством гидроксильных групп, присутствующих в структуре соединения [ 28 ]. PT ингибируют α-глюкозидазу, которая отвечает за поэтапное удаление концевых остатков глюкозы из цепей N-гликана, связанных с созреванием гликопротеина. Большинство гликопротеинов вирусной среды содержат N-связанные гликаны, и ингибиторы α-глюкозидазы были предложены в качестве полезных противовирусных агентов широкого спектра действия на основе их активности против вирусов в оболочке [29 ]. Продемонстрированы противовоспалительные [ 30 ], противоаллергические [ 31 ], противовирусные [ 32 ] и противоопухолевые [ 33 ] свойства, а также противодиабетические и радиозащитные эффекты [ 34 ] этих биологически активных соединений.
Методы получения ФП, их идентификации и установления структуры достаточно подробно описаны в многочисленных работах [ 13 , 14 , 35 ]. Основная сложность экстракции ПП возникает из-за их присутствия в виде сложных полимерных смесей, например, с полисахаридами, которые наряду с белками являются основным ковалентно связанным компонентом клеточной стенки водорослей [ 36 ].
3. Взаимодействие полифенолов морских водорослей с вирусами с оболочкой и без оболочки.
Устойчивость вирусов к неблагоприятным факторам окружающей среды определяется их структурой. Есть вирусы с простой и сложной структурой. Простые вирусы или вирусы без оболочки состоят из нуклеиновой кислоты и белковой оболочки (капсида). Сложные или оболочечные вирусы окружены липопротеидной оболочкой (суперкапсидом) над капсидом, что делает их более уязвимыми к неблагоприятным факторам окружающей среды [ 5 , 6 , 23 ].
Вирусы в оболочке и без нее также различаются по устойчивости к химическим веществам, в том числе дезинфицирующим средствам. Таким образом, вирусы гриппа, парагриппа и коронавирусы в липопротеиновой оболочке являются патогенами с низкой устойчивостью; аденовирусы более устойчивы; а риновирус без оболочки - один из очень устойчивых патогенов, таких как полиовирус и вирус гепатита А [ 37 ].
- А.
-
Взаимодействие полифенолов морских водорослей с оболочечными вирусами
В последние годы проводятся интенсивные исследования противовирусной активности полифенольных соединений наземных растений, а также различных морских водных организмов, в том числе макроводорослей [ 38 , 39 , 40 , 41 ]. Сообщается, что в основном вирусы в оболочке чувствительны к PP. На рисунке 2 показаны мишени вируса в оболочке, на которые могут воздействовать полифенолы растений.
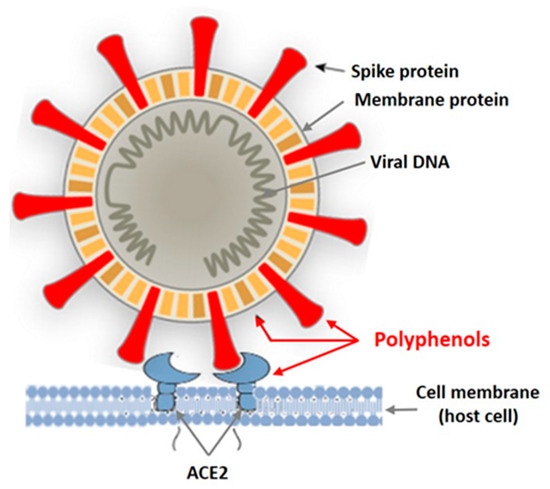
Рисунок 2. Мишени оболочечного вируса для полифенолов морских и наземных растений.
Танины известны как мощные инактиваторы белков, в том числе вирусных. М. Винк [ 38 , 39 ] показал, что танины растений при взаимодействии с вирусным белком образуют несколько водородных и ионных связей, которые действуют на трехмерную структуру белка, подавляя его активность. Поскольку дубильные вещества наземных растений и дубильные вещества водорослей схожи по структуре, механизмы их взаимодействия с вирусами в оболочке, вероятно, аналогичны. Полифенолы связываются с белками вирусной оболочки, предотвращая взаимодействие патогена с клеткой-хозяином.
Коронавирусы - это вирусы с оболочкой. На сегодняшний день известно 39 известных видов вирусов с оболочкой, каждый из которых состоит из десятков и сотен штаммов. Помимо нуклеиновой кислоты и связанного с ней структурно-защитного белка (в коронавирусах это белок N), они также имеют мембранную оболочку. Жизненный цикл коронавирусов предоставляет множество потенциальных целей для противовирусного вмешательства. Подходы к разработке противокоронавирусных препаратов включают воздействие вируса на этапах проникновения и проникновения вирусной частицы в клетку, репликацию вирусной нуклеиновой кислоты, высвобождение вириона из клетки и воздействие на клеточные мишени хозяина. .
Одним из представителей коронавирусов является вирус эпидемической диареи свиней (PEDL). Впервые зарегистрированный в США в 2013 году, он нанес серьезный экономический ущерб во многих странах из-за значительной смертности новорожденных поросят. PEDL инфицирует клетки, выстилающие тонкий кишечник свиньи, вызывая тяжелую эпидемическую диарею и обезвоживание [ 40 , 41 ].
Возбудитель исследован с помощью электронной и иммуноэлектронной микроскопии. Было показано, что он отличается от известных к тому времени коронавирусов: вируса трансмиссивного гастроэнтерита свиней (TGS) и гемагглютинирующего энцефаломиелита свиней. Kwon et al. [ 42 ] обнаружили противовирусный эффект экстракта этанола и пяти флортанинов, полученных из бурой водоросли Ecklonia cava, против PEDL. Экстрагированные соединения были идентифицированы как флороглюцин (1), эккол (2), 7-флорекол (3), флорофукофуроэкол (4) и диекол (5). Соединения (4) и (5) присутствовали в этанольном экстракте из морских водорослей в достаточно больших количествах [ 29 ].
Для оценки противовирусной активности соединений in vitro были использованы две стратегии: блокирование связывания вируса с клетками (получение эффекта лечения одновременно с инфекцией) и ингибирование репликации вируса (получение эффекта лечения после заражения). . Использование прежней экспериментальной схемы позволило установить, что соединения (2–5) обладают противовирусной активностью в отношении PEDL с 50% ингибирующей концентрацией (IC 50) в диапазоне от 10,8 ± 1,4 до 22,5 ± 2,2 мкМ. Соединения (2–5) полностью блокировали связывание вирусного белка с сиаловой кислотой при концентрациях ниже 36,6 мкМ, ингибируя гемагглютинацию. Результаты использования последней экспериментальной схемы показали, что эти соединения также блокировали репликацию вируса со значениями IC50 12,2 ± 2,8 и 14,6 ± 1,3 мкМ соответственно, ингибируя синтез РНК и вирусного белка, но не подавляли репликацию вируса. вирусные протеазы [ 28 , 30 , 31 ]. Что касается цитотоксичности экстракта, CC 50 составлял 533,6 мкг / мл и колебался от 374,4 до 579 мкМ для соединений (4) и (5). Эксперименты проводились с использованием самых низких токсичных (> 90% жизнеспособности клеток) концентраций экстракта [ 30, 31 ].
Активность ФТ распределялась следующим образом: диэкол (16,6 ± 3,0 мкМ)> 7 флорофукофуроэкол (18,6 ± 2,3 мкМ)> эккол (22,5 ± 2,3 мкМ). Флороглюцин неактивен. Активность ПТ распределялась следующим образом: диэкол (16,6 ± 3,0 мкМ)> 7-флофукофуроэкол (18,6 ± 2,3 мкМ)> эккол (22,5 ± 2,3 мкМ). Флороглюцин неактивен. На активность ПТ влияло количество гидроксильных групп. Таким образом, олигомеризация и существование циклопентанового кольца могут быть важны для проявления противовирусной активности. Авторы рекомендуют флофукофуроэкол и диеколь из бурых морских водорослей E. cava в качестве потенциальных агентов, которые действуют на наиболее важные мишени PEDV.
- Б.
-
Взаимодействие ФТ водорослей с вирусами без оболочки.
Однако вирусы в оболочке чувствительны не только к действию фенольных соединений растений, в частности дубильных веществ. Ueda et al. [ 43] обнаружили, например, что экстракты хурмы, содержащие около 22% таннина, снижают инфекционность вирусов без оболочки (полиовирус, вирус Коксаки, аденовирус, ротавирус, кальцивирус кошек и норовирус мыши) более чем на 4 log. Авторы считают, что основной механизм противовирусного действия экстракта связан с агрегацией вирусных белков, о чем свидетельствует конкурентное подавление противовирусного эффекта БСА. Флоротаннины водорослей также оказывают ингибирующее действие на вирусы без оболочки. Такие результаты отмечены для вируса папилломы человека (ВПЧ). В качестве примера мы рассмотрим ВПЧ, небольшой вирус без оболочки, имеющий капсид кубической симметрии и содержащий два белка, L1 и L2. Первый - это основной белок капсида, который составляет более 80% материала капсида, формирование блоков (капсомеров), из которых строится капсид. Антитела против L1 обладают вируснейтрализующей активностью. L2 - это минорный белок, участвующий в стабилизации капсида и связывающийся с геномом [44 ]. Генитальная инфекция, вызываемая вирусом папилломы человека (ВПЧ), является наиболее распространенным заболеванием, передающимся половым путем. Большинство случаев рака шейки матки связано с этой инфекцией. Поэтому существует значительный интерес к новым эффективным нереактогенным препаратам для лечения и профилактики этого заболевания.
Ким и Квак [ 44 ] исследовали влияние ПВ из бурой водоросли E. bicyclis на ВПЧ. Было обнаружено, что экстракт EtOH морских водорослей проявлял противовирусную активность против HPV 16PV и HPV 18PV. Затем экстракт последовательно разделяли CH2Cl2, EtOAc и н-BuOH. Наиболее активная фракция EtOAc была использована для хроматографического разделения, и в результате были выделены эккол, 8,8'-биеколм, 6,6'-биекол и флофукофуроекол. Антивирусная активность оценивалась в культуре клеток 293Т с использованием биолюминесценции. Все соединения показали снижение вирусной нагрузки обоих вирусов при концентрации 50 мкг / мл.
Норовирусы, безоболочечный тип энтеровирусов, считаются ведущей причиной эпидемий заболеваний, сопровождающихся рвотой, диареей, легкой лихорадкой, спазмами в животе и тошнотой [ 45 , 46 ]. Норовирус характеризуется длительным периодом изоляции, низкой инфекционной дозой, высокой устойчивостью, значительным разнообразием и частыми мутациями генома. Вирус передается через зараженную воду или пищу и распространяется фекально-оральным путем при контакте с инфицированными материалами. Вирус имеет геном одноцепочечной положительной смысловой РНК [ 47 ]. В последние годы были предприняты попытки найти безвредные средства лечения и профилактики инфекций среди наземных и морских организмов и водорослей [ 48 ]. С этой целью Eom et al. [ 40] исследовали возможность использования экстракта морских водорослей E. bicyclis и его ингредиентов в качестве альтернативного средства против норовируса. Следующие фракции были получены из EtOAc-растворимого экстракта E. bicyclis: флофукофуроэкол A (PFE) и диеколь (DE).
Экстракт MeOH и его компоненты не проявили значительной цитотоксичности. CC 50 составлял от 322,48 до 2146,42 мкг / мл. Экстракт EtOAc показал сильную противовирусную активность и низкую цитотоксичность. Ранее [ 40 ] авторы описали структуру компонентов экстракта DE и PFE и их ярко выраженные противовирусные свойства. PFE подавляет норовирусную инфекцию более интенсивно, чем DE. Значения селективного индекса (SI) для DE и PFE были примерно в 20 и 25 раз выше, чем у галлата эпигаллокатехина зеленого чая. Противовирусная активность DE при IC 50 составила 0,9 ± 0,06, SI — CC 50 IC 50 - 550,6 ± 6,09; PFE, IC 50 —0,9 ± 0,07, SI — 668,87 ± 73,06 [ 49 ].
Полученные авторами результаты указывают на перспективность использования ФТ водорослей E. bicyclis против норовирусной инфекции. Они предположили, что PT предотвращают прикрепление вирусов к клеткам-хозяевам, и предложили провести углубленное изучение механизмов антиротавирусного действия этих соединений.
Экстракт и ФТ (эккол и PFE) из морских водорослей E. cava использовались для усиления защиты от вируса геморрагической септицемии без оболочки (VHSV), вызывающего очень заразное заболевание пресноводных и морских рыб в разном возрасте [ 41 ]. Используя культуру клеток толстоголового гольяна, было обнаружено, что экстракт и РТ в низких концентрациях проявляли сильную противовирусную активность. При одновременной обработке клеток экстрактом и ПК с инфекцией значения увеличивались (46,4–96,4%) по сравнению с таковыми в вариантах эксперимента до (16,5–48,4%) и после заражения (39,5–56, 5%). %). IC 50для экстракта эккол и PFE составляли 4,76 мкМ, 1,97 мкМ и 0,99 мкМ соответственно. Эффект усиливался в зависимости от времени воздействия. В экспериментах in vivo экстракт морских водорослей, вводимый перорально в различных дозах камбале, инфицированной VHSV, увеличивал выживаемость рыб (на 31,57% при дозе 500 мкг / г / день; на 12,5% при 50 мкг / г / сутки). день) 12,5%) [ 40 ].
Таким образом, не только вирусы в оболочке, но и вирусы без оболочки чувствительны к СТ морских водорослей. Механизм действия этих соединений по отношению к первым более известен.
This entry is adapted from the peer-reviewed paper 10.3390/biomedicines9020200
This entry is offline, you can click here to edit this entry!
