Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Gastroenterology & Hepatology
胃癌被列为全球第五大最普遍的癌症,长期以来一直是许多人热烈讨论的话题。然而,近年来,社会上胃癌的发病率并没有下降,反而呈逐渐上升的趋势。十多年来,胃癌的治疗效果一直没有明显改善。这归因于癌症的异质性,这使得流行的靶向治疗无效。蛋氨酸是一种必需氨基酸,许多研究表明它与胃癌的发展有关。
- gastric cancer
- methionine
- helicobacter pylori
- programmed cell death
- immune response
- gastric cancer
1. 引言
在中国,胃癌在所有类型癌症的发病率中排名第二,也是癌症相关死亡率第二高的国家。与大多数发达国家相比,中国的死亡率与发病率之比更高(0.845),5年患病率为27.6例/10万人[1]。更值得关注的是,早发性胃癌(early-onset gastric cancer, EOGC)在中国年轻人群中的患病率不断上升[2]。
胃癌的危险因素很多[3],包括幽门螺杆菌感染[4]、吸烟[5,6,7]、饮食习惯、腹部肥胖[8]、酗酒[9]以及基因和遗传学[9]。在中国,随着卫生条件的改善和人们对健康的重视,胃癌的发病率通过幽门螺杆菌感染患病率的降低[10,11][12]、腌制食品的减少[13]等降低。然而,由于生活和工作环境的变化,以及生活方式的转变,出现了导致癌症发展的新因素[14]。工作压力加重、腹部肥胖和不健康的饮食习惯(如依赖外卖、加工肉类、烧烤、油炸食品和夜宵)等因素已被确定为胃癌发病率增加的潜在因素[1,15,16,17,18].值得注意的是,这些因素对中国的年轻人口(50岁以下)产生了重大影响。这种特殊形式的胃癌通常被称为早发性胃癌[19]。它被认为与胃炎、胃肠道菌群失调以及抗生素和抑酸剂的使用增加有关[20]。根据解剖位置,胃癌可大致分为贲门胃癌、非贲门胃癌和胃食管交界处癌。同样,根据Lauren分类,胃癌可分为两种主要类型:弥漫型和肠型[21]。
然而,尽管对胃癌的研究越来越多,但胃癌的治疗结果与十多年前的状态相比并没有显著改善[23]。早期非转移性胃癌主要采用内镜治疗或手术切除[24]。对于非EGJ胃癌患者,目前的标准治疗方法是D2胃切除术,然后辅助化疗。可切除的晚期胃癌(C iii.或以上)患者可考虑新辅助治疗[25]。对于晚期 EGJ 胃癌患者,可选择新辅助放化疗。获批用于治疗胃癌的靶向治疗包括曲妥珠单抗作为HER2阳性患者的一线治疗,雷莫西尤单抗作为抗血管生成的二线治疗,以及纳武利尤单抗或帕博利珠单抗作为抗PD-1的三线治疗[26]。围手术期或辅助化疗可提高1b期及以上癌症患者的生存率[27]。序贯化疗,从铂类和氟嘧啶开始[28],用于晚期胃癌。然而,中位生存时间仍然不到 1 年。此外,许多分子靶向药物的II期和III期临床试验都失败了。分析原因后得出结论,患者癌细胞分子特征的异质性使得分子靶向药物的疗效高度不稳定[29,30,31,32,33,34,35,36]。这表明,使用分子靶向药物治疗胃癌可能不是一个理想的途径。因此,寻找一种可以减轻异质性影响的治疗胃癌的新方法是一个紧迫的问题。
蛋氨酸(Met)是人体中不能在体内合成的必需氨基酸之一。大量研究表明[37]胃癌细胞对Met的依赖性,缺乏Met的环境有利于化疗对胃癌的疗效。此外,γMetase酶可以通过裂解蛋氨酸来抑制胃癌细胞的增殖[38]。这表明Met可能刺激胃癌细胞增殖。此外,Met可以通过腺苷转移酶直接转化为S-腺苷甲硫氨酸(SAM),腺苷酸转移酶是体内重要的直接甲基供体。SAM在甲基化过程中起着重要作用,为体内50多种物质贡献甲基[39]。因此,Met可以通过各种途径影响胃癌的进展。一方面,Met转化为SAM可以逆转原癌基因低甲基化,从而降低其表达,从而抑制胃癌细胞的增殖[40,41,42,43]。
2. Met与蛋氨酸循环的关系
Met 是一种必需氨基酸,其代谢受称为蛋氨酸循环的核心循环控制。在这个循环中,Met通过Met腺苷转移酶(MAT)的作用转化为SAM。然后,SAM在甲基转移酶反应中充当甲基供体。该过程的必要副产物是S-腺苷同型半胱氨酸(SAH)[54],它被SAHH酶水解,形成同型半胱氨酸(Hcy)。Hcy通过转化为同型半胱氨酸硫内酯或通过反式硫化途径从循环中消除,导致半胱氨酸的形成。或者,再甲基化可以通过两种途径发生:一种途径利用以 B12 为辅因子和 5-甲基四氢叶酸作为甲基供体的蛋氨酸合酶,另一种途径涉及以甜菜碱为甲基供体的甜菜碱同型半胱氨酸甲基转移酶。总体而言,Met循环通过提供底物与三种重要的代谢途径连接并相互作用(图1)。
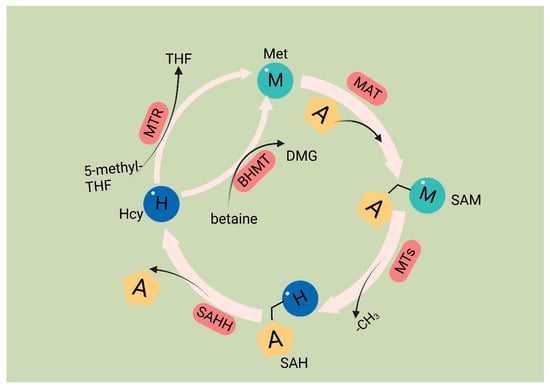
图 1.蛋氨酸循环。蛋氨酸循环的第一步是通过蛋氨酸腺苷转移酶 (MAT) 将蛋氨酸转化为 S-腺苷甲硫氨酸 (SAM)。SAM 在提供甲基化反应的甲基后转化为 S-腺苷同型半胱氨酸 (SAH)。该步骤由甲基转移酶 (MT) 介导。然后SAH被S-腺苷-L-同型半胱氨酸水解酶(SAHH)水解,生成同型半胱氨酸。最后,同型半胱氨酸从叶酸循环或甜菜碱中接收甲基成为蛋氨酸;这些反应由 5-甲基四氢叶酸介导:分别是同型半胱氨酸甲基转移酶 (MTR) 和甜菜碱-同型半胱氨酸甲基转移酶 (BHMT)。蛋氨酸循环通过提供底物与三个重要的代谢途径相互连接。这些途径包括叶酸循环、转硫途径、蛋氨酸回收途径和多胺合成,所有这些都支持重要的细胞功能。Met:蛋氨酸;SAM:S-腺苷蛋氨酸;MAT:满足腺苷转移酶;SAH: S-腺苷同型半胱氨酸;MTs: 甲基转移酶;Hcy:同型半胱氨酸;DMG: 二甲基甘氨酸;BHMT:甜菜碱-同型半胱氨酸甲基转移酶;5-甲基四氢呋喃:5-甲基四氢叶酸;THF:四氢叶酸;MTR:甲基转移酶。
在癌细胞中,Met的缺乏导致翻译起始位点的异常识别,从而抑制蛋白质合成[55]。Met在癌细胞功能中的重要性已被广泛研究。通过代谢周期产生的代谢物在各种细胞内过程中起着至关重要的作用,包括多胺合成、DNA合成、氧化还原稳态和甲基化反应[19]。SAM是甲基转移酶(MTases)的甲基供体,MTases是一种促进甲基转移到各种生物大分子的酶,包括DNA、RNA、蛋白质和其他需要通过添加甲基进行甲基化的代谢物[56]。失去甲基后,SAM转化为SAH。SAH对DNA甲基转移酶(DNMTs)和组蛋白甲基转移酶(histone methyltransferases, HMTs)的催化能力有显著影响[57]。SAH决定DNA和组蛋白甲基转移酶的活性[54]。SAH经过水解产生Hcy。Hcy有两种潜在的命运;它可以进入转硫途径,也可以被甲基化形成Met,从而将Met循环与转硫途径连接起来。Hcy进入转硫途径导致谷胱甘肽(GSH)的产生,谷胱甘肽在氧化还原稳态中起作用。癌细胞中存在的活性氧(ROS)可以通过PI3K通路促进癌细胞增殖[58]。
3. Met在胃癌病理生理学中的机制
3.1. Met在幽门螺杆菌存活和感染中的作用机制
幽门螺杆菌(Helicobacter pylori, Hp)感染是胃癌的重要危险因素,被国际癌症研究机构(International Agency for Research on Cancer, IARC)列为1类致癌物[4]。感染 Hp 后,邻近的胃上皮细胞会经历复杂的炎症反应。这种环境触发免疫细胞释放各种细胞因子、活性氧 (ROS) 和一氧化氮 (NO)。这些炎症介质随后激活DNA甲基转移酶,导致CpG岛的高甲基化,并最终导致相关基因表达的下调[65]。此外,Hp感染后,胃上皮细胞会发生表观遗传改变,包括E-钙调蛋白的甲基化,这一过程可能导致胃癌转移[66]。根除Hp后,表观遗传改变显著改善,导致Hp诱导的胃癌发生延迟[67]。Hp在胃中茁壮成长面临多种挑战,例如酸性环境和氧化应激[68,69,70]。Hp 具有多种抵消氧化应激的机制。一个突出的机制涉及过氧化氢酶,它促进过氧化氢和氧气转化为危害较小的化合物。先前的研究表明,过氧化物酶和脲酶中的Met残基可以起到非催化作用,以减轻氧化应激。具体机理涉及Met残基与氧化剂结合,导致蛋氨酸亚砜(Met-SO)的形成,随后可通过蛋氨酸亚砜还原酶(Msr)还原为蛋氨酸残基。这建立了Met-S/Met-SO循环,有效减少了Hp中的氧化损伤[49,71]。
此外,有证据表明,Met的直接前体Hcy合成内源性硫化氢(H2S)通过降解途径。Hcy 转换为 H2通过三种途径实现S:胱硫氨酸β-合酶(CBS)、胱硫氨酸γ-裂解酶(CSE)和3-巯基丙酮酸磺基转移酶(3MST)[72]。这种代谢过程促进血管舒张、血管生成,抑制白细胞粘附到血管壁上,并上调抗氧化分子[73,74]。
3.2. Met在胃癌细胞程序性细胞死亡中的机制
程序性细胞死亡,称为细胞凋亡,是一种由遗传决定的、活跃的、有序的细胞死亡过程。这种机制起到了防止内部和外部环境因素刺激的保护措施的作用。有四种公认的程序性细胞死亡类型:细胞凋亡、程序性坏死、细胞焦亡和铁死亡。
此外,MR环境中的胃癌细胞没有表现出腹膜扩散,并且在体内实验中观察到了相同的有利结果。后续研究表明,MR 培养基完全去甲基化了内源性 E-cadherin (CDH1) 基因,并增强了 MKN45 和 KATOIII 细胞系中 CDH1 的表达。CDH1 是一种细胞间粘附蛋白。在弥漫性胃癌病例中,CDH1的启动子区通常被高甲基化,这与CDH1蛋白表达的下调密切相关;此外,临床证据表明,CDH1蛋白表达的下调会导致胃癌表型更具侵袭性,胃癌患者的预后更差[81,82]。
最近的研究表明[46],Met裂解酶(Metase)的过表达显著促进胃癌细胞的凋亡和自噬。此外,用Metase转染SGC7901和MKN45细胞系可显著增强细胞凋亡。值得注意的是,Beclin1、Atg5 和 Atg7 蛋白的表达以及自噬标志物 LC3-I 比率显着升高。
研究[45]发现,重组蛋氨酸酶(rMetase)处理后,胃癌细胞系中PI1K的表达、磷酸化Akt(p-Akt)与总Akt(t-Akt)的比值、GLUT-2和关键糖酵解酶(如HK2、PFKM和LDHA)的表达下调。此外,抗凋亡蛋白 Bcl-3 下调,而促凋亡蛋白 Bax 和半胱氨酰天冬酰胺-7901 上调。临床证据表明,BCL-3下调可延长胃癌患者的生存期[86]。
铁死亡是一种独特的非凋亡细胞死亡调节形式,主要由脂质过氧化过度触发[90]。它是最近发现的一种程序性细胞死亡机制,主要在肿瘤细胞中观察到。代谢重编程有可能改变对铁诱导的细胞死亡的敏感性。细胞中铁、脂质和谷氨酰胺的代谢被认为是影响细胞对铁中毒易感性的关键代谢过程[90,91]。众所周知,细胞受到三个主要抗氧化轴的保护,即胱抑素/GSH/GPX4轴、FSP1/CoQ10轴和GCH1/BH4/DHFR轴[92]。
3.3. Met在胃癌免疫反应中的作用机制
由免疫系统引起的慢性炎症被广泛认为是癌症发展的一个突出因素[95]。因此,癌症被某些学者称为“持续性伤口”[96]。毫无疑问,免疫系统在癌症的发展和进展中起着至关重要的作用[97]。一个说明性的例子是幽门螺杆菌诱发慢性胃炎的能力,从而将幽门螺杆菌确定为胃癌发展的重要危险因素。此外,在癌症晚期,免疫系统可以刺激癌细胞迁移并增强恶性细胞的侵袭性[98]。免疫系统对癌症的影响延伸到肿瘤微环境。癌细胞通过诱导免疫细胞因子释放来利用免疫细胞,导致微环境改变,促进肿瘤血管生成和组织重塑[99,100]。由于癌细胞和宿主细胞之间的异质性以及癌细胞的快速生长,癌细胞与免疫系统有关。当癌细胞的生长速度超过血液中的能量供应时,就会发生坏死,导致细胞碎片的产生和大量的促炎因子。这些因子激活免疫系统,随后募集免疫细胞[101,102]。
临床和实验室证据表明,癌细胞能够通过吸收环境中的大量Met来逃避免疫系统[105,106,107]。MR疗法有可能被用作抑制癌症进展的免疫疗法,这并不意外[108]。
已经证明,MR 或抑制 MATA2 通过抑制组蛋白 H3 (H3K4me3) 上的赖氨酸-4 和组蛋白 H3 (H3K27me3) 上的赖氨酸-27 的三甲基化来降低 RIP1 的表达。因此,这种抑制会阻碍胃癌中单核细胞/巨噬细胞的浸润[109]。单核细胞/巨噬细胞是胃癌免疫细胞浸润的重要组成部分[110]。
总体而言,Met在胃癌免疫中的作用至关重要。MR不仅抑制胃癌细胞的发育,还阻碍单核细胞/巨噬细胞的浸润。虽然补充Hcy对MR对胃癌细胞的影响不受影响,但它减轻了癌细胞对T细胞的竞争性抑制,促进了T细胞的增殖和分化。虽然胃癌细胞表现出异质性,但体内的免疫细胞是我们的正常细胞,不同胃癌患者之间同类型的免疫细胞差异很小。因此,受Met影响的机制被认为是可推广的。
3.4. MET 对胃癌干细胞影响的机制
胃癌干细胞 (GCSC) 是一种特定的癌细胞亚型,其特征在于它们能够自我更新并分化为其他癌细胞类型。人们普遍认为,在胃癌中观察到的侵袭、转移和对化疗的耐药性可归因于 GCSC 的存在和活性。这些细胞在胃癌的进展和治疗反应中起重要作用[119]。由于GCSC的快速扩散速度,对Met的需求很高。在喂食MR但暴露于Hcy的小鼠中,GCSCs的增殖率显着降低。RAB37 是一种小的 GTP 酶蛋白,负责细胞信号传导和囊泡转运,可通过与自噬相关基因 5 (ATG5) 结合诱导自噬;此外,临床研究表明,ATG5下调促进胃癌侵袭,RAB37表达下调与癌症转移和预后不良有关[120,121,122]。后续研究表明,MR通过两种途径增强了RAB37的作用,促进了GCSCs的自噬,并降低了GCSCs的增殖率。 首先,MR降低了RAB37的甲基化,导致RAB37表达的上调。此外,调节 miR-200b/PKCα 轴间接增加了 RAB37 的活性。这些作用导致GCSCs的自噬增加和增殖率降低[40]。
3.5. MET在胃癌化疗中的作用和机制
尽管在胃癌病例中观察到显着的异质性,但晚期患者的治疗方法差异很小。通常,对于局限性晚期癌症患者,标准治疗包括切除后辅助化疗[128]。辅助化疗通常需要一种称为 FLOT 的方案,该方案由多西紫杉醇、奥沙利铂、5-氟尿嘧啶和亚叶酸组成。这种围手术期化疗药物的组合已成为西方国家的标准治疗[129]。对于晚期弥漫性胃癌患者,对于被认为不适合手术的患者,应考虑选择新辅助放疗[130]。
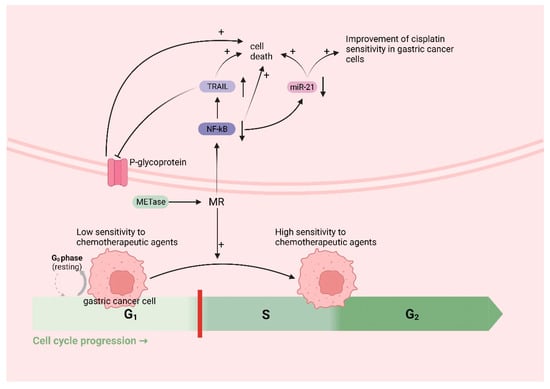
Met是甲基供体的体内来源。MR诱导被困在G0/G1期的癌细胞进入S/G2期,随后停滞[134,135]。这是细胞DNA经历快速复制的时期,使其成为癌细胞对化疗高度敏感的黄金时间。因此,从理论上讲,MR可以增强化疗药物治疗癌症的疗效。越来越多的研究表明,MR可以与各种化疗药物协同作用;例如,大都会的癌细胞−/Hcy+培养基选择性地阻滞在S/G2期,进一步消除克隆细胞,使癌细胞对细胞周期特异性药物敏感[64],包括5-氟尿嘧啶[136]、吉西他滨[137]、顺铂[52]、多柔比星(DOX)、长春新碱(VCR)[138]等。除了诱导化疗敏感的 S/G2 期外,MR 还可能通过替代途径增强化疗药物的疗效。由于通过定期喂养实现 MR 的挑战,研究人员利用易于获得的蛋氨酸酶 (METase) 作为创建 MR 环境的更直接方法。一项研究表明[52]METase能够恢复耐药胃癌细胞对顺铂的敏感性。其具体机制涉及抑制METase治疗后胃癌细胞中核因子-κB(NF-κB)活性,导致肿瘤坏死因子相关凋亡诱导配体(TRAIL)表达上调,随后P-gp下调。此外,NF-κB的失活导致miR-21表达下调,进一步增强了胃癌细胞对顺铂的敏感性[139]。NF-κB是一种转录因子,可以激活抗凋亡蛋白等分子,从而减少胃癌细胞的凋亡[140]。TRAIL可以选择性地诱导癌细胞死亡,而不会对正常细胞造成伤害[141](图5)。

图5.MR 可提高胃癌的化疗疗效:MR 诱导被困在 G0/G1 期(对化疗药物敏感性低)的癌细胞进入 S/G2 期(对化疗药物敏感性高)。MR下调核因子-κB(NF-κB),导致肿瘤坏死因子相关凋亡诱导配体(TRAIL)表达上调,随后P-gp下调,癌细胞死亡;miR-21表达下调,进一步增强胃癌细胞对顺铂的敏感性,诱导癌细胞死亡;NF-κB下调,诱导癌细胞死亡。
This entry is adapted from the peer-reviewed paper 10.3390/biom14020161
This entry is offline, you can click here to edit this entry!
