Your browser does not fully support modern features. Please upgrade for a smoother experience.
Please note this is an old version of this entry, which may differ significantly from the current revision.
Subjects:
Oncology
SIRT6 jest deacetylazą zależną od dinukleotydu nikotynoamidoadeninowego (NAD + ), zlokalizowaną głównie w jądrze, biorącą udział w procesach modyfikacji histonów, naprawy DNA, regulacji cyklu komórkowego i apoptozy. Zaobserwowano zaburzenia w poziomie ekspresji SIRT6 w rozwoju i progresji różnych typów nowotworów. Dlatego ważne jest lepsze zrozumienie roli SIRT6 w szlakach biochemicznych i przypisanie mu konkretnych funkcji biologicznych.
- sirtuins
- histone
- deacetylation
- SIRT6 inhibitors
1. Wstęp
Liczne modyfikacje potranslacyjne zmieniają interakcję między DNA, białkami histonowymi, czynnikami transkrypcyjnymi (TF) i chromatyną. Modyfikacje te obejmują acetylację, metylację, fosforylację, ubikwitynację, sumoilację i ADP-rybozylację [ 1 ]. Acetylacja i deacetylacja to ważne mechanizmy odpowiedzialne za regulację transkrypcji genów poprzez modulację interakcji DNA z białkami histonowymi i niehistonowymi [ 2 , 3 ]. Są one katalizowane odpowiednio przez acetylotransferazy histonowe (HAT) i deacetylazy histonowe (HDAC). HAT katalizują przeniesienie grup acetylowych z acetylokoenzymu A (Acetylo-CoA) do grupy ε-aminowej reszt lizyny w białkach docelowych. Deacetylację acetylowanych białek przeprowadzają HDAC, które katalizują hydrolityczne usuwanie grup acetylowych z reszt lizyny białek [ 4 ]. Acetylacja i deacetylacja histonów mają znaczący wpływ na wiele procesów, w tym transkrypcję genów, podział komórek, różnicowanie, naprawę DNA i autofagię [ 4 , 5 ]. Dlatego równowaga pomiędzy aktywnością HAT/HDAC odgrywa ważną rolę w regulacji ekspresji genów i sygnalizacji komórkowej [ 4 ].
Sirtuiny (SIRT) to rodzina enzymów należących do klasy III deacetylaz histonowych, która obejmuje siedmiu członków (SIRT1-7) [ 6 ]. Wszystkie wykazują aktywność deacetylacji histonów w obecności dinukleotydu nikotynowo-adeninowego (NAD + ), który podczas tej reakcji przekształca się w nikotynamid (NAM). NAM można przekształcić z powrotem do NAD + lub zmetylować przez N-metylotransferazę nikotynamidową (NNMT), która usuwa NAM ze szlaku odzyskiwania NAD. Dlatego aktywność NNMT wpływa na dostępność NAD + dla reakcji przeprowadzanych przez SIRT, które wpływają na homeostazę organizmu za pośrednictwem sirtuiny [ 7 ]. SIRT biorą udział w licznych procesach zachodzących w komórce. Uczestniczą w procesie utrzymania homeostazy, stabilności genomu, reakcji na stres i starzenia się [ 8 ].
Deacetylazy sirtuiny
Istnieją cztery klasy deacetylaz histonowych (HDAC), podzielone ze względu na substrat reakcji, którą katalizują. Klasy I, II i IV wykorzystują jony cynku jako kofaktor w reakcji, a klasa III wymaga NAD + do katalizy [ 10 ]. SIRT należą do rodziny wysoce konserwatywnych białek, które odgrywają ważną rolę w profilowaniu apoptozy komórek, żywotności komórek, powstawaniu nowotworów i przerzutach [ 11 ]. Obecnie u ssaków znanych jest siedem enzymów SIRT, które podzielono na cztery klasy. Wszystkie są homologami drożdży Sir2 i wykazują zależną od dinukleotydu nikotynoamidoadeninowego (NAD + ) aktywność deacetylazy i mono-ADP-rybozylotransferazy. Wszystkie SIRT mają konserwatywną domenę, która wiąże NAD + ; różnią się jednak domenami karboksylowymi i aminokońcowymi, co wpływa na ich aktywność katalityczną i lokalizację komórek [ 12 ]. SIRT usuwają grupę acylową przyłączoną do grupy aminowej reszt lizyny obecnych w acylowanych białkach i do tego procesu wykorzystują jedną cząsteczkę NAD + na każdą cząsteczkę usuniętego łańcucha acylowego. W rezultacie uwalniane są trzy produkty: acylowana ADP-ryboza, deacylowane białko i nikotynamid [ 13 ]. NAD + jest bardzo ważnym koenzymem w licznych przemianach metabolicznych, co czyni SIRT niezbędnymi regulatorami szlaków biochemicznych odpowiedzialnych za podział komórek, starzenie się i proces nowotworowy ( ryc. 1 ) [ 8 , 14 ].
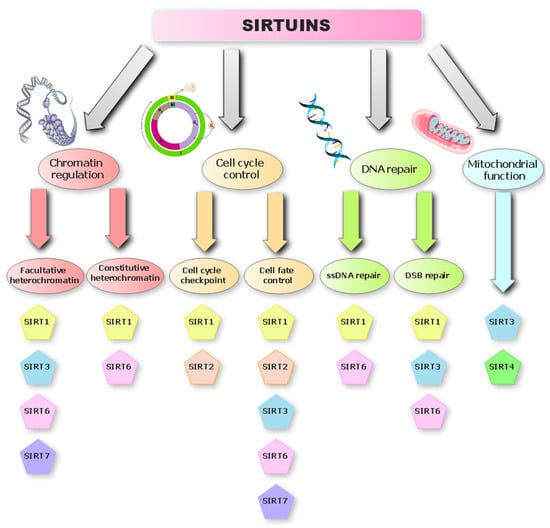
Rycina 1. Rola sirtuin w mechanizmach stabilności genomu.
2. Struktura SIRT6
Jednym z mniej zbadanych SIRT jest sirtuina 6 (SIRT6), białko enzymatyczne należące do sirtuin klasy I, zlokalizowane w jądrze komórkowym [ 12 , 17 ]. SIRT6 składa się z 355 aminokwasów [ 10 ], z czego 275 tworzy rdzeń katalityczny zawierający dwie sferyczne domeny składające się z ośmiu α-helis i dziewięciu nici β: dużą domenę Rossmanna (reszty 25–128 i 191–266) i małą domena wiążąca cynk zawierająca cynk z czterema resztami cysteiny, Cys141, Cys144, Cys166 i Cys177 [ 18 , 19 ], które tworzą specyficzną strukturę odpowiedzialną za wiązanie NAD + koenzym [ 13 ]. Duża domena Rossmanna składa się z sześciu arkuszy β (β1, β2, β3, β7, β8 i β9), które znajdują się pomiędzy sześcioma helisami α (α1, α4, α5, α6, α7 i α8). Mała domena składa się z dwóch pętli rozciągających się od dużej domeny (łączących β3 i α6) i trzech plisowanych arkuszy β (β4, β5 i β6). Domena wiążąca małe jony zawiera motyw wiążący cynk: sekwencję Cys-XX-Cys-X15-20-Cys-XX-Cys z wstawką składającą się z 10 reszt pomiędzy drugim zestawem cystein, co daje wysoce elastyczną wydłużoną pętlę [ 18 ]. Kieszeń wiążąca NAD + w SIRT została podzielona na trzy elementy, A, B i C. Miejsce A jest odpowiedzialne za wiązanie reszty adenozyny, podczas gdy miejsce B wiąże się z resztą rybozy nikotynamidu. Reakcja katalityczna zachodzi w szczelinie hydrofobowej pomiędzy dwiema domenami, a SIRT6 jest jedynym SIRT, który może wiązać NAD + przy braku acylowanego substratu białkowego [ 19 ]. W przeciwieństwie do pozostałych SIRT, SIRT6 nie ma pojedynczej helisy łączącej domenę Rossmanna i motyw wiążący cynk, a także brakuje mu elastycznej pętli wiążącej NAD + ; zamiast tego ma stabilną pojedynczą helisę. Dlatego jest prawdopodobne, że SIRT6 może wiązać NAD + bez udziału acetylowanego substratu, w przeciwieństwie do innych SIRT [ 18 ]. Dodatkowo SIRT6 posiada wydłużony kanał acylowy, dzięki czemu in vitro hydrolizuje grupy tłuszczowo-acylowe z większą wydajnością niż grupa acetylowa [ 19 ]. Reakcję deacetylacji katalizowaną przez SIRT6 przedstawiono na rysunku 2 .
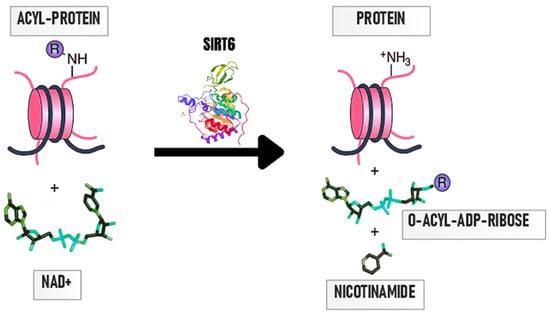
Rycina 2. SIRT6 jest deacetylazą histonową zależną od NAD + . W wyniku przyłączenia NAD + do SIRT6 z białka zostaje usunięta grupa acylowa. W wyniku reakcji powstaje nikotynamid, O-acylo-ADPryboza i deacylowane białka [ 13 ].
3. Znaczenie deacetylacji białek przez SIRT6
Plejotropowe działanie SIRT6, zarówno jako zależnej od (NAD + ) deacetylazy histonowej (HDAC), jak i mono-ADP-rybozylotransferazy, pozwala mu bezpośrednio lub pośrednio wpływać na ważne procesy związane z modyfikacją histonów, naprawą uszkodzeń DNA, homeostazą komórek i apoptozą ( ryc. 1 ) [ 20 ]. Deacetylazy, takie jak SIRT6, to białka, które usuwają grupy acetylowe z innych białek, zwłaszcza z histonów w chromatynie. Histony to białka, które pomagają w pakowaniu DNA w małą strukturę przypominającą chromatynę, która jest obecna w jądrze komórek eukariotycznych. SIRT6 działa jako deacetylaza histonowa, powodując odłączenie grupy acetylowej od reszt lizyny histonów H3, zwłaszcza w miejscach H3K9, H3K18, H3K27 i histon H4, umożliwiając SIRT6 regulację ważnych metabolicznie szlaków [ 17 ].
Odkryto, że SIRT6 jest niezbędny do zachowania integralności genomu i hamowania starzenia się komórek. Oddziałuje z acetylowanym histonem H3 lizyną 9 (H3K9ac) na końcach chromosomów zwanych telomerami i propaguje wyspecjalizowany stan chromatyny, który jest niezbędny do prawidłowego funkcjonowania i metabolizmu telomerów [ 16 ].
Apoptoza, naturalny proces programowanej śmierci komórki, który zachodzi w organizmach wielokomórkowych w celu pozbycia się uszkodzonych lub niepożądanych komórek, jest regulowany przez SIRT6 [ 21 ]. Apoptoza jest kontrolowana przez złożoną sieć szlaków sygnalizacyjnych obejmujących wiele białek, w tym czynniki proapoptotyczne, takie jak Bax i antyapoptotyczne, takie jak Bcl-2. SIRT6 jest w stanie modulować apoptozę poprzez aktywność deacetylazy. Po uszkodzeniu DNA SIRT6 może promować apoptozę poprzez mono-ADP-rybozylację p73 i p53 w różnych komórkach nowotworowych [ 22 ]. W komórkach raka wątrobowokomórkowego (HCC) nadekspresja SIRT6 upośledza proliferację komórek nowotworowych poprzez hamowanie sygnalizacji ERK1/2 i indukuje apoptozę poprzez zwiększenie poziomu rozszczepionej kaspazy-3 [ 23 ].
Aktywność mono-ADP-rybozylotransferazy SIRT6 wspiera rybozylację reszt lizyny i argininy chromatyny w celu ułatwienia naprawy DNA i stabilizacji regionów heterochromatycznych [ 15 ]. Rybozylacja polimerazy poli(ADP-rybozy) 1 (PARP-1) na lizynie 521 przez SIRT6 zwiększa aktywność PARP-1, promując w ten sposób naprawę uszkodzeń DNA [ 17 ].
3.1. Rola deacetylacji białek za pośrednictwem SIRT6 w karcynogenezie
3.1.1. Rola SIRT6 jako onkogenu
SIRT6 pełni podwójną funkcję w rozwoju nowotworu, którą można powiązać z jego zdolnością do kontrolowania różnych szlaków sygnałowych. Wykazano na przykład, że SIRT6 kontroluje aktywność onkogenów, np. MYC i supresorów nowotworów, np. TP53 [ 28 ].
Wraz z β-kateniną SIRT6 uczestniczy w wielu komórkowych szlakach sygnałowych, w tym tych, które przyczyniają się do rozwoju nowotworu [ 29 ]. Badania przeprowadzone na nowotworach jelita grubego, piersi, jajnika, wątroby, płuc i innych nowotworach wykazały korelację między ekspresją SIRT6, wzrostem guza i wynikami klinicznymi. Knockdown SIRT6 hamował migrację i inwazję komórek raka jajnika (OC) OVCAR3 i OVCAR5, ale nie hamował proliferacji komórek. Zależną od SIRT6 inwazyjność komórek OC powiązano z ekspresją cząsteczek związanych z EMT, takich jak aktywowana β-katenina, ślimak, wimentyna, E-kadheryna i N-kadheryna. Co więcej, ekspresja SIRT6 i aktywnej β-kateniny była skorelowana z wyższym stopniem histologicznym, stadium nowotworu i opornością na platynę w ludzkich rakach jajnika.
3.1.2. Rola SIRT6 jako supresora nowotworu
SIRT6 promotes apoptotic cell death when DNA damage is present, preventing damaged cells from proliferation [33]. The downregulation of SIRT6 has been shown to promote tumor development and invasiveness in vivo. Importantly, loss of SIRT6 expression may lead to tumor formation even without the activation of known oncogenes and transformed SIRT6-deficient cells exhibit increased cancer growth and glycolysis, suggesting that SIRT6 plays an important role in both the establishment and maintenance of tumors. A metabolic shift towards glycolysis known as the Warburg effect, which is crucial for maintaining fast tumor development, was also shown to be mediated by SIRT6. The deletion of SIRT6 in vivo increases the number, growth, and aggressiveness of tumors and SIRT6 expression can predict patients’ survival, indicating that SIRT6 acts as a potent tumor suppressor that inhibits cancer metabolism [34].
Loss of SIRT6 causes the recruitment of Myc and the activation of the downstream let-7 target genes (IGF2BP1 and HMGA2) and IGF2BP3, which stimulates PDAC development and metastasis [28]. It was shown that dysregulated USP10 function promotes carcinogenesis via SIRT6 degradation in human colon cancer and the crosstalk between UPS10 and SIRT6 controls cell-cycle progression and proliferation. USP10, a ubiquitin-specific peptidase, decreases SIRT6 ubiquitination and protects SIRT6 from proteasomal degradation.
The c-Jun/c-Fos/SIRT6 pathway controls the liver cancer initiation and survival of initiated cancer cells. c-Fos stimulates SIRT6 transcription, which downregulates survivin by lowering histone H3K9 acetylation and the activation of NF-κB. Increasing the SIRT6 expression or targeting the anti-apoptotic function of survivin at the cancer initiation stage noticeably impairs tumor development [36]. It was shown that SIRT6 functions as a tumor suppressor in hepatocellular carcinoma (HCC) through the binding and deacetylating of nuclear pyruvate kinase M2 (PKM2), which suppresses the oncogenic functions of PKM2, resulting in decreased cancer cell proliferation, migration, and invasiveness [37]. SIRT6 is downregulated in human liver cancer, and SIRT6 knockout in HCC induces oncogenic changes including global hypomethylation, decreased apoptosis, and metabolic changes, such as increased fat deposition and hypoglycemia [38]. SIRT6 is also downregulated in OC tissues, and SIRT6 overexpression decreases the proliferation of SKOV3 and OVCAR3 OC cells through the suppression of Notch 3 [39].
4. Screening of SIRT6 Inhibitors and Activators
4.1. SIRT6 Activators
4.1.1. 4H-Chromen
4H-chromen, syntetyczny związek o budowie chemicznej podobnej do kwercetyny, był w stanie zwiększyć aktywność deacetylazy SIRT6 ponad 30-krotnie. Według analizy kinetycznej 4H-chromen wzmaga deacetylację SIRT6 w mechanizmie analogicznym do małocząsteczkowych aktywatorów. Wiąże się z miejscem w kieszeni hydrofobowej zawierającej centrum katalityczne reakcji deacetylacji. Zasugerowano, że 4H-chromen zwiększa powinowactwo substratów do miejsca aktywnego, stymulując w ten sposób proces deacetylacji za pośrednictwem SIRT6.
4.1.2. MDL-811
MDL-811, nowo odkryty allosteryczny aktywator SIRT6, promuje deacetylację EZH2 i ekspresję FOXC1, co powoduje złagodzenie uszkodzenia niedokrwiennego mózgu, zapalenia nerwów i poprawę wyników leczenia udaru [ 44 ]. Według analizy dokowania, MDL-811 wiąże się z kieszenią allosteryczną SIRT6 poprzez wiązania wodorowe z Phe86 i uczestniczy w oddziaływaniach hydrofobowych z Val153 i Phe86 [ 44 ]. W komórkach raka jelita grubego (CRC) MDL-811 wzmaga deacetylację histonów H3 za pośrednictwem SIRT6 (H3K9Ac, H3K18Ac i H3K56Ac) i hamuje proliferację linii komórkowych CRC i organoidów pochodzących od pacjentów [ 45 ].
4.1.3. MDL-800
MDL-800 bezpośrednio wiąże się z powierzchniowym miejscem allosterycznym SIRT6 i zwiększa jego aktywność deacetylacyjną [ 47 ]. MDL-800 aktywuje SIRT6 poprzez zwiększenie powinowactwa wiązania kofaktorów i acylowanych substratów, a także zwiększenie wydajności katalitycznej SIRT6.
4.1.4. Fluwastatyna
Fluwastatyna jest silnym inhibitorem reduktazy 3-hydroksy-3-metyloglutarylokoenzymu A (HMG-CoA), stosowanej w leczeniu chorób układu krążenia i hipercholesterolemii. Ponadto wykazuje obiecującą aktywność przeciwko komórkom raka piersi, wątroby i endometrium. Fluwastatyna stymuluje zależną od SIRT6 deacetylację histonu H3 (H3K9ac i H3K56ac) w komórkach HepG2. Krystalografia rentgenowska ujawniła, że związek ten działa poprzez przyłączenie się do miejsca wyjścia acylu substratu SIRT6, a następnie utworzenie kompleksu SIRT6/ADP-ryboza/fluwastatyna [ 19 ].
4.2. Inhibitory SIRT6
4.2.1. Kwercetyna
Kwercetyna, flawonoid występujący w różnego rodzaju warzywach i owocach, wykazuje różne działanie farmakologiczne, w tym działanie przeciwnowotworowe [ 50 ]. Kwercetyna może modulować aktywność SIRT6, działając jako inhibitor w niskich stężeniach i aktywator w wysokich stężeniach. Analizy struktury krystalicznej i testy wiązania wykazały, że związki na bazie kwercetyny aktywują deacetylację za pośrednictwem SIRT6 poprzez wiązanie się ze specyficznym dla SIRT6 kanałem wiązania acylu. Ponadto wykazano, że kwercetyna hamuje aktywność demirystoilacji za pośrednictwem SIRT6 poprzez wiązanie się z dystalnym miejscem kanału acylowego SIRT6 [ 51 ]. Z kolei dwie pochodne kwercetyny, 2-chloro-1,4-naftochinono-kwercetyna i dikwercetyna, zostały zidentyfikowane jako inhibitory SIRT6.
4.2.2. Pochodne chinazolinedionu
Stwierdzono, że pochodne chinazolinedionu hamują aktywność SIRT6 w zakresie mikromolowym, ale mają umiarkowaną selektywność SIRT6/SIRT1. Związki te wykazywały konkurencyjny wzór hamowania wobec kofaktora NAD + poprzez wiązanie z miejscem aktywnym SIRT6 i były w stanie zwiększyć acetylację histonu H3K9. Ponieważ SIRT6 współpracuje z polimerazą poli [ADP-rybozy] 1 (PARP-1) w naprawie pęknięć dwuniciowych DNA, oceniano wpływ ich hamowania w liniach komórkowych raka trzustki Capan 1 (PaC) z niedoborem BRCA-2. Hamowanie aktywności SIRT6 za pomocą pochodnych chinazolinedionu nasilało działanie przeciwnowotworowe olaparybu, inhibitora PARP-1, poprzez hamowanie wzrostu komórek Capan-1. Dodatkowo, leczenie linii komórkowej PaC BxPC-3 obydwoma inhibitorami zmniejszyło syntezę czynnika martwicy nowotworu α (TNF-α) i zwiększyło wychwyt glukozy [ 52 ].
5. Podsumowanie Sirtuin jako potencjalnego celu terapeutycznego
Sirtuiny (SIRT), rodzina deacetylaz zależnych od NAD + , odgrywają kluczową rolę w regulacji procesów komórkowych, w tym w patogenezie nowotworów. Ich udział w tych nowotworach jest złożony i wieloaspektowy i wpływa na takie aspekty, jak chemiooporność, przerzuty i ogólny postęp choroby [ 53 ]. W kontekście HNSCC za istotne czynniki uznano SIRT1, SIRT3 i SIRT7, jednak ich dokładne mechanizmy działania pozostają częściowo poznane. W szczególności SIRT1 wykazuje podwójną rolę w HNSCC, z obniżoną ekspresją w komórkach nowotworowych i potencjalnym wkładem w chemiooporność. Kluczowe znaczenie ma zrozumienie, w jaki sposób SIRT1 wpływa na odpowiedź komórek nowotworowych na chemioterapię, zwłaszcza na leki takie jak cisplatyna. Modulacja aktywności SIRT1 może znacząco wpłynąć na skuteczność leczenia raka. Nadekspresja SIRT3 w nowotworach jamy ustnej sugeruje jego potencjał jako celu terapeutycznego. Badania nad inhibitorami SIRT3 mogą dostarczyć nowych informacji na temat zwiększania skuteczności istniejących metod leczenia HNSCC.
6. Wnioski
Sirtuiny (SIRT), deacetylazy histonowe klasy III (HDAC), to grupa wysoce konserwatywnych białek, które odgrywają ważną rolę w regulacji proliferacji, migracji, przerzutów i apoptozy komórek. Jedną z mniej znanych sirtuin jest SIRT6, która wykazuje aktywność zarówno deacetylazy zależnej od (NAD + ), jak i aktywności mono-ADP-rybozylotransferazy. Białko to bierze udział w kontroli różnych szlaków odpowiedzialnych za rozwój nowotworu. Rola SIRT6 w karcynogenezie jest złożona, ponieważ ta deacetylaza ulega odmiennej ekspresji w różnych typach komórek nowotworowych w porównaniu z komórkami normalnymi. Dynamiczne zmiany poziomu SIRT6 w komórkach nowotworowych wskazują na jego istotną rolę w procesie karcynogenezy i progresji nowotworu. Regulacja aktywności SIRT6 poprzez leczenie małocząsteczkowymi modulatorami może hamować proliferację i inwazję, indukować apoptozę, uwrażliwiać komórki nowotworowe na istniejące środki przeciwnowotworowe i zmniejszać wzrost guza in vivo.
This entry is adapted from the peer-reviewed paper 10.3390/ijms25010497
This entry is offline, you can click here to edit this entry!
