A purificação de biomoléculas com alto grau de especificidade, como as lectinas, tem despertado interesse no uso de leitos fixos não tradicionais funcionalizados com ligantes de particular interesse. A interação é robusta o suficiente para permitir a adsorção de glicoproteínas e reversível o suficiente para permitir a dissociação de moléculas em resposta a mudanças no pH da solução. Estudos sobre adsorventes não convencionais, como suportes cromatográficos, podem fundamentar, enriquecer e auxiliar projetos em diversas áreas do conhecimento. Criogênios de poliacrilamida são emergentes e eficientes, podendo ser sintetizados e ter suas matrizes modificadas para múltiplos fins e técnicas cromatográficas. Também são funcionais e apresentam baixo custo quando comparados aos adsorventes cromatográficos convencionais. Nesse contexto, as lectinas podem ser utilizadas principalmente na prevenção de doenças autoimunes e em estudos com biossensores.
- purification of bio compounds
- macromolecules
- affinity chromatography
1. Introdução
2. Atividade da lectina
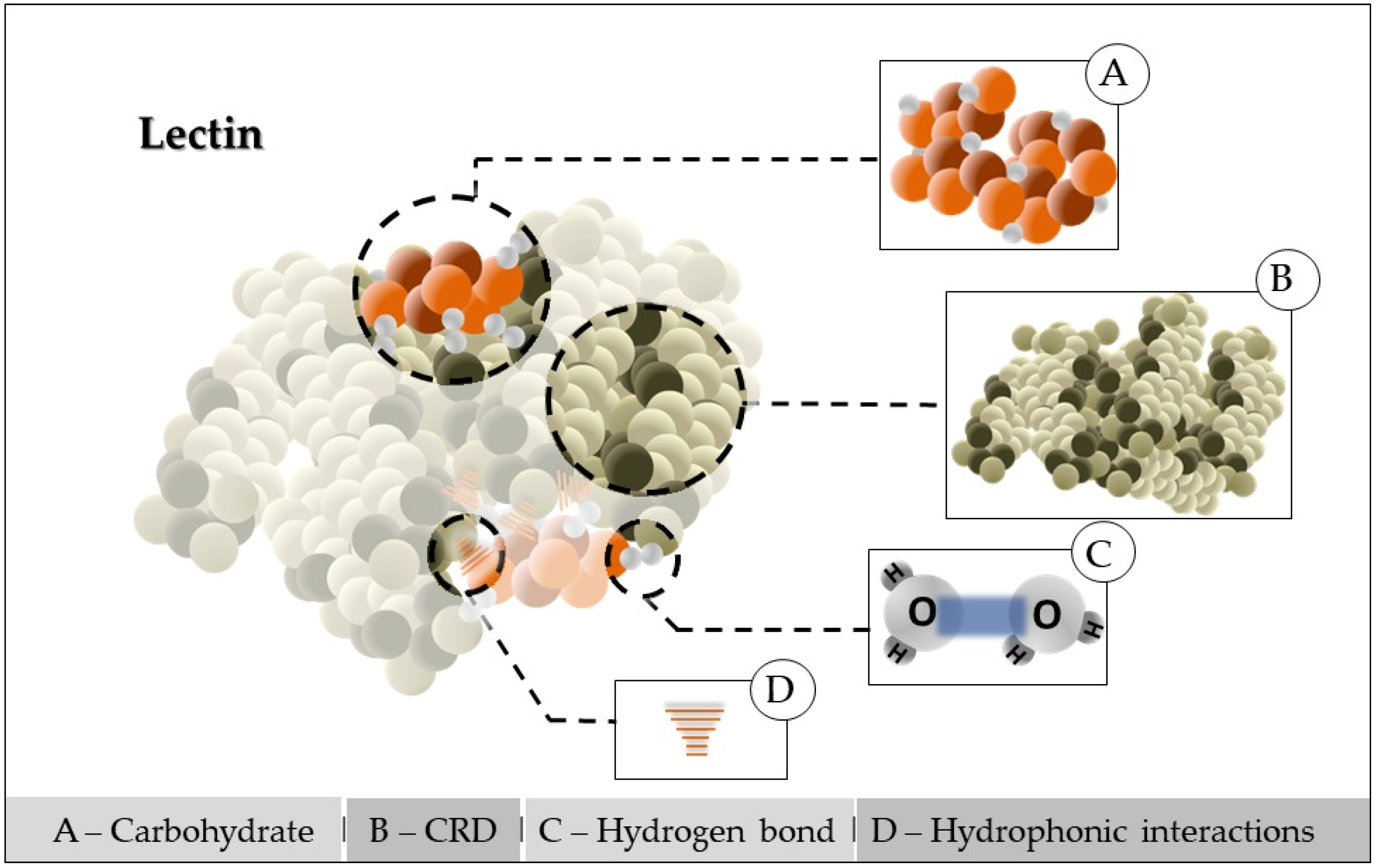
This entry is adapted from the peer-reviewed paper 10.3390/separations10010036
References
- Janson, J.C. Principles, High Resolution Methods, and Applications. In Protein Purification; John Wiley & Sons: Hoboken, NJ, USA, 2011; pp. 3–50. ISBN 978-0-471-74661-4.
- Dainiak, M.B.; Allan, I.U.; Savina, I.N.; Cornelio, L.; James, E.S.; James, S.L.; Mikhalovsky, S.v.; Jungvid, H.; Galaev, I.Y. Gelatin-Fibrinogen Cryogel Dermal Matrices for Wound Repair: Preparation, Optimisation and in Vitro Study. Biomaterials 2010, 31, 67–76.
- Perçin, I.; Khalaf, R.; Brand, B.; Morbidelli, M.; Gezici, O. Strong Cation-Exchange Chromatography of Proteins on a Sulfoalkylated Monolithic Cryogel. J. Chromatogr. A 2015, 1386, 13–21.
- Tao, S.P.; Wang, C.; Sun, Y. Coating of Nanoparticles on Cryogel Surface and Subsequent Double-Modification for Enhanced Ion-Exchange Capacity of Protein. J. Chromatogr. A 2014, 1359, 76–83.
- Ünlüer, Ö.B.; Ersöz, A.; Denizli, A.; Demirel, R.; Say, R. Separation and Purification of Hyaluronic Acid by Embedded Glucuronic Acid Imprinted Polymers into Cryogel. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2013, 934, 46–52.
- Banerjee, S.; Chaki, S.; Bhowal, J.; Chatterjee, B.P. Mucin Binding Mitogenic Lectin from Freshwater Indian Gastropod Belamyia Bengalensis: Purification and Molecular Characterization. Arch. Biochem. Biophys. 2004, 421, 125–134.
- Oliveira, J.T.A.; Melo, V.M.M.; Câmara, M.F.L.; Vasconcelos, I.M.; Beltramini, L.M.; Machado, O.L.T.; Gomes, V.M.; Pereira, S.P.; Fernandes, C.F.; Nunes, E.P.; et al. Purification and Physicochemical Characterization of a Cotyledonary Lectin from Luetzelburgia Auriculata. Phytochemistry 2002, 61, 301–310.
- Roy, I.; Sardar, M.; Gupta, M.N. Cross-Linked Alginate-Guar Gum Beads as Fluidized Bed Affinity Media for Purification of Jacalin. Biochem. Eng. J. 2005, 23, 193–198.
- Gonçalves, G.R.F.; Gandolfi, O.R.R.; Santos, C.M.S.; Bonomo, R.C.F.; Veloso, C.M.; Fontan, R.d.C.I. Development of Supermacroporous Monolithic Adsorbents for Purifying Lectins by Affinity with Sugars. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2016, 1033–1034, 406–412.
- Ourth, D.D.; Rose, W.M. Purification, Characterization and Seasonal Variation of Mannose-Binding C-Type Lectin in Ictalurid Catfish. Aquaculture 2011, 321, 191–196.
- Jung, W.K.; Park, P.J.; Kim, S.K. Purification and Characterization of a New Lectin from the Hard Roe of Skipjack Tuna, Katsuwonus Pelamis. Int. J. Biochem. Cell Biol. 2003, 35, 255–265.
- Arora, S.; Saxena, V.; Ayyar, B.V. Affinity Chromatography: A Versatile Technique for Antibody Purification. Methods 2017, 116, 84–94.
- Mallik, R.; Hage, D.S. Affinity Monolith Chromatography. J. Sep. Sci. 2006, 29, 1686–1704.
- Pfaunmiller, E.L.; Paulemond, M.L.; Dupper, C.M.; Hage, D.S. Affinity Monolith Chromatography: A Review of Principles and Recent Analytical Applications. Anal. Bioanal. Chem. 2013, 405, 2133–2145.
- Ferreira da Silva, J.; Lemos da Silva, D.; Gomes Nascimento, R.; Ayra Alcântara Veríssimo, L.; Martins Veloso, C.; Ferreira Bonomo, R.C.; da Costa Ilhéu Fontan, R. Enhancements in Sugar Immobilization in Polymeric Macroporous Matrices for Affinity Capture. J. Appl. Polym. Sci. 2019, 136, 47956.
- Gondim, A.C.S.; Romero-Canelón, I.; Sousa, E.H.S.; Blindauer, C.A.; Butler, J.S.; Romero, M.J.; Sanchez-Cano, C.; Sousa, B.L.; Chaves, R.P.; Nagano, C.S.; et al. The Potent Anti-Cancer Activity of Dioclea Lasiocarpa Lectin. J. Inorg. Biochem. 2017, 175, 179–189.
- Suzuki, T.; Abe, T.; Umehara, K.; Choi, J.H.; Hirai, H.; Dohra, H.; Kawagishi, H. Purification and Characterization of a Lectin from the Mushroom Hypsizigus Marmoreus. Mycoscience 2015, 56, 359–363.
- Selvaprakash, K.; Chen, Y.C. Functionalized Gold Nanoparticles as Affinity Nanoprobes for Multiple Lectins. Colloids Surf. B Biointerfaces 2018, 162, 60–68.
- Matoba, Y.; Sato, Y.; Oda, K.; Hatori, Y.; Morimoto, K. Lectins Engineered to Favor a Glycan-Binding Conformation Have Enhanced Antiviral Activity. J. Biol. Chem. 2021, 296.
- Gajbhiye, V.; Gong, S. Lectin Functionalized Nanocarriers for Gene Delivery. Biotechnol. Adv. 2013, 31, 552–562.
- He, S.; Shi, J.; Walid, E.; Zhang, H.; Ma, Y.; Xue, S.J. Reverse Micellar Extraction of Lectin from Black Turtle Bean (Phaseolus Vulgaris): Optimisation of Extraction Conditions by Response Surface Methodology. Food Chem. 2015, 166, 93–100.
- Lavín de Juan, L.; García Recio, V.; Jiménez López, P.; Girbés Juan, T.; Cordoba-Diaz, M.; Cordoba-Diaz, D. Pharmaceutical Applications of Lectins. J. Drug Deliv. Sci. Technol. 2017, 42, 126–133.
- Santos, A.L.E.; Júnior, C.P.S.; Neto, R.N.M.; Santos, M.H.C.; Santos, V.F.; Rocha, B.A.M.; Sousa, E.M.; Carvalho, R.C.; Menezes, I.R.A.; Oliveira, M.R.C.; et al. Machaerium Acutifolium Lectin Inhibits Inflammatory Responses through Cytokine Modulation. Proc. Biochem. 2020, 97, 149–157.
- Carrillo, C.; Cordoba-Diaz, D.; Cordoba-Diaz, M.; Girbés, T.; Jiménez, P. Effects of Temperature, PH and Sugar Binding on the Structures of Lectins Ebulin f and SELfd. Food Chem. 2017, 220, 324–330.
- Singh, A.; Trans, K.S.-C.S. Effect of Temperature, PH and Denaturing Agents on Biological Activity of MCJ Lectin. Chem. Sci. Trans. 2013, 2.
- Sharon, N.; Lis, H. Legume Lectins—A Large Family of Homologous Proteins. FASEB J. 1990, 4, 3198–3208.
- Kanellopoulos, P.N.; Tucker, P.A.; Pavlou, K.; Agianian, B.; Hamodrakas, S.J. A Triclinic Crystal Form of the Lectin Concanavalin A. J. Struct. Biol. 1996, 117, 16–23.
