AThe purificação detion of biomoléculas com alto grau de eecules with a high degree of specificidade, comoty, such as lectinas, tem despertados, has garnered interesse no uso de leitos fixos não tradicionait in the use of fixed non-traditional beds functionalizados comed with ligantes deds of particular interesse. At. The interação éction is both robusta o suficiente para permitir a enough to permit the adsorção de gliption of glycoproteínas eins and reversível o suficiente para permitir aible enough to permit the dissociação de moléculas emtion of molecules in resposta a mudanças no pH da solução. Estudos sobre adsorventes não nse to changes in the solution’s pH. Studies on unconvencionais, como suportes ctional adsorbents, such as chromatográficos, podem fundamentaraphic supports, can substantiate, enriquecer e auxiliarch, and assist projetos em diversas áreas do conhecimento. Criogênios de poliacrilamida sãocts in various areas of knowledge. Polyacrylamide cryogens are emergentes e eing and efficientes, podendo ser sintetizados e ter suas matriz, and can be synthesized and have their matrices modificadas para múltiplos fins e técnicas ced for multiple purposes and chromatográficas. Também sãaphic techniques. They are also funcionais e apresentam baixo custo quando tional and have low costs comparados aos adsorventes ced to conventional chromatográficos convencionais. Nesseaphic adsorbents. In this contexto, as, lectinas podem ser utilizadas principalmente na s can mainly be used in the prevenção de doençastion of autoimunes e em estudos com biossensoremmune diseases and in studies with biosensors.
- purification of bio compounds
- macromolecules
- affinity chromatography
1. Introduçãction
2. Lectin Atividade da lectinactivity
Conceiptualmentelly, lectinas sãos are proteínas de origem não imune que reconhecem e estãoins of non-immune origin that recognize and are associadas ated with carboidratos ou glihydrates or glycoconjugados de forma reversível, com alta afinidade e etes reversibly, with high affinity and specificidade. Devido a essa habilidade, essasty. Due to this ability, these biomoléculas têm efeitos biológicos importantes, como inseticidaecules have important biological effects, such as insecticide, bactericidal, antitumoral e , and fungicida, além de umae, in addition to an injunção sobre action on HIV-I protease do HIV-I, e tornaram-se, and became essential instrumentos essenciais nos in the diagnóstico de doençaosis of diseases, identificação de cepas de micrtion of microorganismos e em estudo strains, and in studies relacionados a tipos sanguíneos. Lectinas vegetais têm sido utilizadas emted to blood types. Plant lectins have been used in cell biologia celular e iy and immunologia como agentey as diagnósticos e imostic and immunomoduladores, bem como para fins terapêuticostory agents, as well as for therapeutic purposes [16]. AlémIn disso, podem ser utilizados naaddition, they can be used in the produção de biossensores para a indústria alimentíciaction of biosensors for the food industry, verificando aying the presença de micrce of microorganismos para garantir as to ensure the qualidade de matérias-primas e produtosty of raw materials and industrializadoed products [17][18]. ValeIt is ressaltar que o estudo de worth noting that the study of Matoba et al. [19] increaumentou a atividade antiviral dassed the antiviral activity of lectinas. Taiss. Such proteínas têm como cins have as characterísticas o reconhecimento e a manutenção de ligações específicas e istics the recognition and maintenance of specific and reversíveis a mono ouible bonds to mono- or oligossacarídeos e outrasaccharides and other substânciaances contendo açúcares, mantendo a estruturaaining sugars, maintaining the covalente desses ligantes glicosídico structure of these glycosidic ligands [19]. ElThes podemy can precipitar células, glite cells, glycoconjugados e polissacarídeos de fontestes, and polysaccharides from animais, vegetais, virais el, plant, virus, and bacterianal sources [20][21]. AThe ligação debinding of lectinas com açúcares é atribuída a um domínio ds with sugars is attributed to a carbohydrate reconhecimento de carboidratos (DRC) dentro de sua estrutura polipeptídica. Agnition domain (CRD) within their polypeptide structure. The interação dection of lectinas com determinadoss with certain carboidratos pode ser tão específica quanto a hydrates can be as specific as the interação entre antígeno e anticorpo ouction between antigen and antibody or substrato e enzima. Algumas são metae and enzyme. Some are metalloproteínas, ou seja, requerem ains, in other words, they require the presença de cátions metálicos em seus sítios específicos de ligação com carboidratos em conexão com eles, assemelhando-se ace of metal cations at their specific binding sites with carbohydrates in connection with them, resembling metalloproteases; masbut lectinas não as do not presentam atividade catalítica catalytic activity [20][22]. Generalmente, as ly, lectinas possuem pelo menos dois sítios de ligação paras have at least two binding sites for carboidratos, que permitem ligações cruzadas entre células através de hydrates, which allow cross-linking between cells through combinações com açúcares na superfície ou entre açúcaretions with sugars on the surface or between sugars contidos emained in macromoléculaecules, justificando sua capacidade de aying their ability to agglutinar partículas ete particles and precipitar glite glycoconjugados. A interaçãotes. The lectina-carboidrato é devida a ligações –carbohydrate interaction is due to covalentes, nas quais moléculas de água bonds, in which water molecules, associadas ao grupo polar de proteínas e também ao redor doted with the polar group of proteins and also around the carboidrato, são deslocadashydrate, are displaced (Figurae 1). EThissa modificaçãotion resulta nas in the formação de novas redes de ligação de hidrogênio, que, juntamente com as forças detion of new hydrogen bonding networks, which, together with van der Waals, e forces, stabilizam essae this interaçãoction [7][23].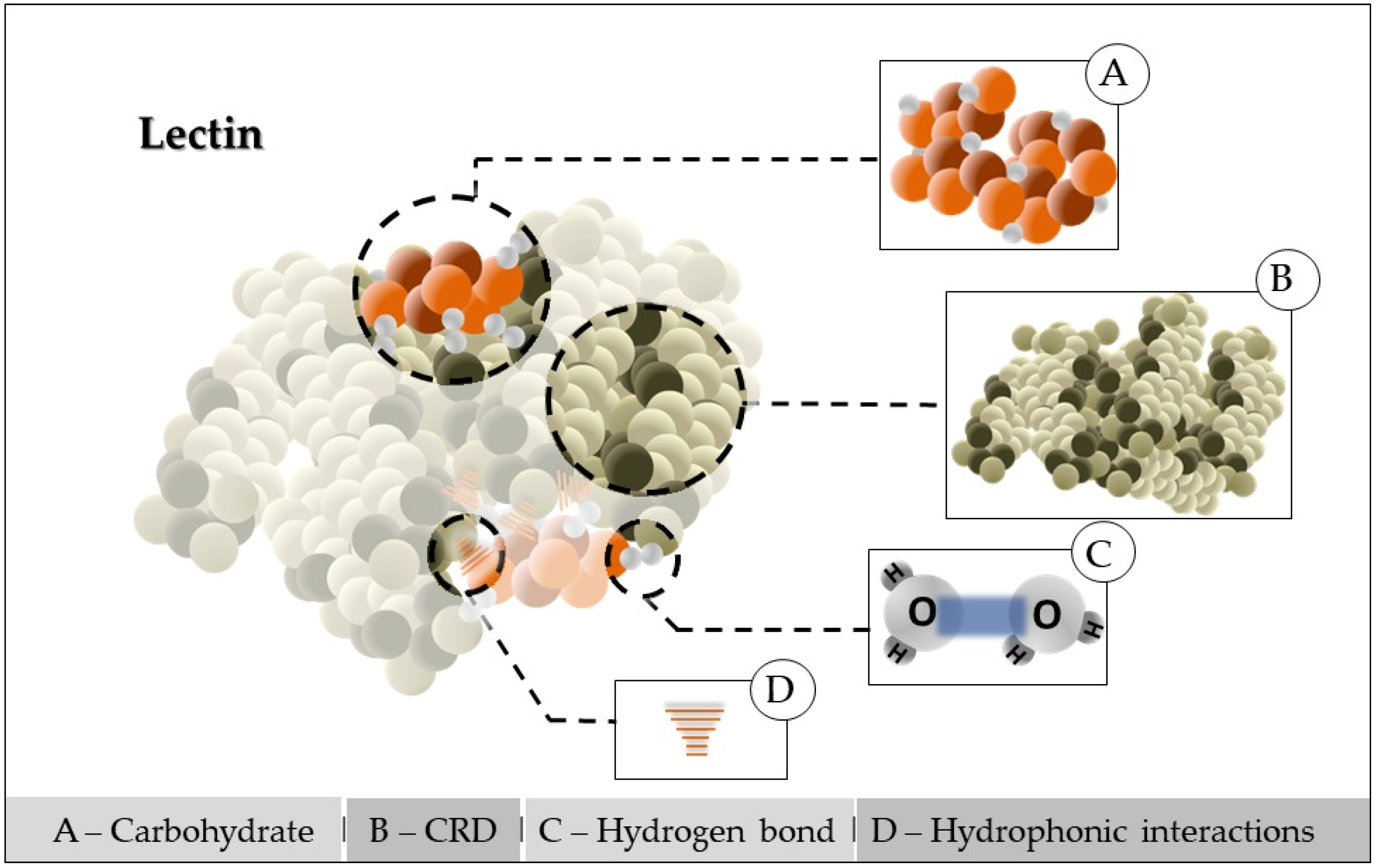
References
- Janson, J.C. Principles, High Resolution Methods, and Applications. In Protein Purification; John Wiley & Sons: Hoboken, NJ, USA, 2011; pp. 3–50. ISBN 978-0-471-74661-4.
- Dainiak, M.B.; Allan, I.U.; Savina, I.N.; Cornelio, L.; James, E.S.; James, S.L.; Mikhalovsky, S.v.; Jungvid, H.; Galaev, I.Y. Gelatin-Fibrinogen Cryogel Dermal Matrices for Wound Repair: Preparation, Optimisation and in Vitro Study. Biomaterials 2010, 31, 67–76.
- Perçin, I.; Khalaf, R.; Brand, B.; Morbidelli, M.; Gezici, O. Strong Cation-Exchange Chromatography of Proteins on a Sulfoalkylated Monolithic Cryogel. J. Chromatogr. A 2015, 1386, 13–21.
- Tao, S.P.; Wang, C.; Sun, Y. Coating of Nanoparticles on Cryogel Surface and Subsequent Double-Modification for Enhanced Ion-Exchange Capacity of Protein. J. Chromatogr. A 2014, 1359, 76–83.
- Ünlüer, Ö.B.; Ersöz, A.; Denizli, A.; Demirel, R.; Say, R. Separation and Purification of Hyaluronic Acid by Embedded Glucuronic Acid Imprinted Polymers into Cryogel. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2013, 934, 46–52.
- Banerjee, S.; Chaki, S.; Bhowal, J.; Chatterjee, B.P. Mucin Binding Mitogenic Lectin from Freshwater Indian Gastropod Belamyia Bengalensis: Purification and Molecular Characterization. Arch. Biochem. Biophys. 2004, 421, 125–134.
- Oliveira, J.T.A.; Melo, V.M.M.; Câmara, M.F.L.; Vasconcelos, I.M.; Beltramini, L.M.; Machado, O.L.T.; Gomes, V.M.; Pereira, S.P.; Fernandes, C.F.; Nunes, E.P.; et al. Purification and Physicochemical Characterization of a Cotyledonary Lectin from Luetzelburgia Auriculata. Phytochemistry 2002, 61, 301–310.
- Roy, I.; Sardar, M.; Gupta, M.N. Cross-Linked Alginate-Guar Gum Beads as Fluidized Bed Affinity Media for Purification of Jacalin. Biochem. Eng. J. 2005, 23, 193–198.
- Gonçalves, G.R.F.; Gandolfi, O.R.R.; Santos, C.M.S.; Bonomo, R.C.F.; Veloso, C.M.; Fontan, R.d.C.I. Development of Supermacroporous Monolithic Adsorbents for Purifying Lectins by Affinity with Sugars. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2016, 1033–1034, 406–412.
- Ourth, D.D.; Rose, W.M. Purification, Characterization and Seasonal Variation of Mannose-Binding C-Type Lectin in Ictalurid Catfish. Aquaculture 2011, 321, 191–196.
- Jung, W.K.; Park, P.J.; Kim, S.K. Purification and Characterization of a New Lectin from the Hard Roe of Skipjack Tuna, Katsuwonus Pelamis. Int. J. Biochem. Cell Biol. 2003, 35, 255–265.
- Arora, S.; Saxena, V.; Ayyar, B.V. Affinity Chromatography: A Versatile Technique for Antibody Purification. Methods 2017, 116, 84–94.
- Mallik, R.; Hage, D.S. Affinity Monolith Chromatography. J. Sep. Sci. 2006, 29, 1686–1704.
- Pfaunmiller, E.L.; Paulemond, M.L.; Dupper, C.M.; Hage, D.S. Affinity Monolith Chromatography: A Review of Principles and Recent Analytical Applications. Anal. Bioanal. Chem. 2013, 405, 2133–2145.
- Ferreira da Silva, J.; Lemos da Silva, D.; Gomes Nascimento, R.; Ayra Alcântara Veríssimo, L.; Martins Veloso, C.; Ferreira Bonomo, R.C.; da Costa Ilhéu Fontan, R. Enhancements in Sugar Immobilization in Polymeric Macroporous Matrices for Affinity Capture. J. Appl. Polym. Sci. 2019, 136, 47956.
- Gondim, A.C.S.; Romero-Canelón, I.; Sousa, E.H.S.; Blindauer, C.A.; Butler, J.S.; Romero, M.J.; Sanchez-Cano, C.; Sousa, B.L.; Chaves, R.P.; Nagano, C.S.; et al. The Potent Anti-Cancer Activity of Dioclea Lasiocarpa Lectin. J. Inorg. Biochem. 2017, 175, 179–189.
- Suzuki, T.; Abe, T.; Umehara, K.; Choi, J.H.; Hirai, H.; Dohra, H.; Kawagishi, H. Purification and Characterization of a Lectin from the Mushroom Hypsizigus Marmoreus. Mycoscience 2015, 56, 359–363.
- Selvaprakash, K.; Chen, Y.C. Functionalized Gold Nanoparticles as Affinity Nanoprobes for Multiple Lectins. Colloids Surf. B Biointerfaces 2018, 162, 60–68.
- Matoba, Y.; Sato, Y.; Oda, K.; Hatori, Y.; Morimoto, K. Lectins Engineered to Favor a Glycan-Binding Conformation Have Enhanced Antiviral Activity. J. Biol. Chem. 2021, 296.
- Gajbhiye, V.; Gong, S. Lectin Functionalized Nanocarriers for Gene Delivery. Biotechnol. Adv. 2013, 31, 552–562.
- He, S.; Shi, J.; Walid, E.; Zhang, H.; Ma, Y.; Xue, S.J. Reverse Micellar Extraction of Lectin from Black Turtle Bean (Phaseolus Vulgaris): Optimisation of Extraction Conditions by Response Surface Methodology. Food Chem. 2015, 166, 93–100.
- Lavín de Juan, L.; García Recio, V.; Jiménez López, P.; Girbés Juan, T.; Cordoba-Diaz, M.; Cordoba-Diaz, D. Pharmaceutical Applications of Lectins. J. Drug Deliv. Sci. Technol. 2017, 42, 126–133.
- Santos, A.L.E.; Júnior, C.P.S.; Neto, R.N.M.; Santos, M.H.C.; Santos, V.F.; Rocha, B.A.M.; Sousa, E.M.; Carvalho, R.C.; Menezes, I.R.A.; Oliveira, M.R.C.; et al. Machaerium Acutifolium Lectin Inhibits Inflammatory Responses through Cytokine Modulation. Proc. Biochem. 2020, 97, 149–157.
- Carrillo, C.; Cordoba-Diaz, D.; Cordoba-Diaz, M.; Girbés, T.; Jiménez, P. Effects of Temperature, PH and Sugar Binding on the Structures of Lectins Ebulin f and SELfd. Food Chem. 2017, 220, 324–330.
- Singh, A.; Trans, K.S.-C.S. Effect of Temperature, PH and Denaturing Agents on Biological Activity of MCJ Lectin. Chem. Sci. Trans. 2013, 2.
- Sharon, N.; Lis, H. Legume Lectins—A Large Family of Homologous Proteins. FASEB J. 1990, 4, 3198–3208.
- Kanellopoulos, P.N.; Tucker, P.A.; Pavlou, K.; Agianian, B.; Hamodrakas, S.J. A Triclinic Crystal Form of the Lectin Concanavalin A. J. Struct. Biol. 1996, 117, 16–23.
