TheA purification ofção de biomolecules with a high degree of éculas com alto grau de especificity, suchdade, como as lectins, has garneredas, tem despertado interest in the use of fixed non-traditional bedsse no uso de leitos fixos não tradicionais functionalized withados com ligands oftes de particular interest. Thesse. A interaction is both ção é robust enough toa o suficiente para permit their a adsorption of glyção de glicoproteins andínas e reversible enough toível o suficiente para permit their a dissociation of molecules inção de moléculas em response to changes in the solution’s pH. Studies on unsta a mudanças no pH da solução. Estudos sobre adsorventes não conventional adsorbents, such as chcionais, como suportes cromatographic supports, can substantiateáficos, podem fundamentar, enrich, and assistquecer e auxiliar projects in various areas of knowledge. Polyacrylamide cryogens are emerging and eftos em diversas áreas do conhecimento. Criogênios de poliacrilamida são emergentes e eficient, and can be synthesized and have their matrices, podendo ser sintetizados e ter suas matrizes modified for multiple purposes and chcadas para múltiplos fins e técnicas cromatographic techniques. They are alsáficas. Também são functional and have low costsionais e apresentam baixo custo quando compared to conventional chados aos adsorventes cromatographic adsorbents. In thisáficos convencionais. Nesse context,o, as lectins can mainly be used in the as podem ser utilizadas principalmente na prevention ofção de doenças autoimmune diseases and in studies with biosensormunes e em estudos com biossensores.
- purification of bio compounds
- macromolecules
- affinity chromatography
1. Introductiçãon
2. LecAtin Activityvidade da lectina
Concepituallymente, lectins areas são proteins of non-immune origin that recognize and areínas de origem não imune que reconhecem e estão associated withdas a carbohydrates or glyidratos ou glicoconjugatesdos de forma reversibly, with high affinity and ível, com alta afinidade e especificity. Due to this ability, thesedade. Devido a essa habilidade, essas biomolecules have important biological effects, such as insecticideéculas têm efeitos biológicos importantes, como inseticida, bactericidal, antitumor, andal e fungicide, in addition to ana, além de uma injunction on HIV-Ição sobre a protease, and became essential do HIV-I, e tornaram-se instruments in the diagnosis of diseaseos essenciais no diagnóstico de doenças, identification of microção de cepas de microrganism strains, and in studies related to blood types. Plant lectins have been used in cellos e em estudos relacionados a tipos sanguíneos. Lectinas vegetais têm sido utilizadas em biology and imia celular e imunology aia como agentes diagnostic and immósticos e imunomodulatory agents, as well as for therapeutic purposesdores, bem como para fins terapêuticos [16]. InAlém addition, they can be used in the production of biosensors for the food industrydisso, podem ser utilizados na produção de biossensores para a indústria alimentícia, verifying theicando a presence of microça de microrganisms to ensure theos para garantir a quality of raw materials anddade de matérias-primas e produtos industrialized productados [17][18]. ItVale is worth noting that the study ofressaltar que o estudo de Matoba et al. [19] iaumencreased thtou a atividade antiviral activity ofdas lectins. Suchas. Tais proteins have as chínas têm como caracteristics the recognition and maintenance of specific andísticas o reconhecimento e a manutenção de ligações específicas e reversible bonds to mono- oríveis a mono ou oligosaccharides and othersacarídeos e outras substanceâncias containing sugars, maintaining theendo açúcares, mantendo a estrutura covalent structure of these glycosidic ligande desses ligantes glicosídicos [19]. ThEley cans podem precipitate cells, glyr células, glicoconjugates, and polysaccharides fromdos e polissacarídeos de fontes animal, plant, virus, andis, vegetais, virais e bacterial sourcesanas [20][21]. TheA binding ofligação de lectins with sugars is attributed to a carbohydratas com açúcares é atribuída a um domínio de recognition domain (CRD) within their polypeptide structure. Thenhecimento de carboidratos (DRC) dentro de sua estrutura polipeptídica. A interaction ofção de lectins with certainas com determinados carbohydrates can be as specific as theidratos pode ser tão específica quanto a interaction between antigen and antibody orção entre antígeno e anticorpo ou substrate and enzyme. Some are metalo e enzima. Algumas são metaloproteins, in other words, they require theínas, ou seja, requerem a presence of metal cations at their specific binding sites with carbohydrates in connection with them, resemblingça de cátions metálicos em seus sítios específicos de ligação com carboidratos em conexão com eles, assemelhando-se a metalloproteases; butmas lectins do not as não apresent catalytic activityam atividade catalítica [20][22]. Generally, mente, as lectins have at least two binding sites foras possuem pelo menos dois sítios de ligação para carbohydrates, which allow cross-linking between cells throughidratos, que permitem ligações cruzadas entre células através de combinations with sugars on the surface or between sugarções com açúcares na superfície ou entre açúcares contained inidos em macromoleculeéculas, justifying their ability to agicando sua capacidade de aglutinate particles andr partículas e precipitate glyr glicoconjugates. Thedos. A interação lectin–carbohydrate interaction is due to a-carboidrato é devida a ligações covalent bonds, in which water moleculeses, nas quais moléculas de água, associated with thedas ao grupo polar group of proteins and also around thede proteínas e também ao redor do carbohydrate, are displacedidrato, são deslocadas (Figurea 1). ThiEssa modificationção results in the formation of new hydrogen bonding networks, which, together witha na formação de novas redes de ligação de hidrogênio, que, juntamente com as forças de van der Waals forces, s, estabilize thisam essa interactionção [7][23].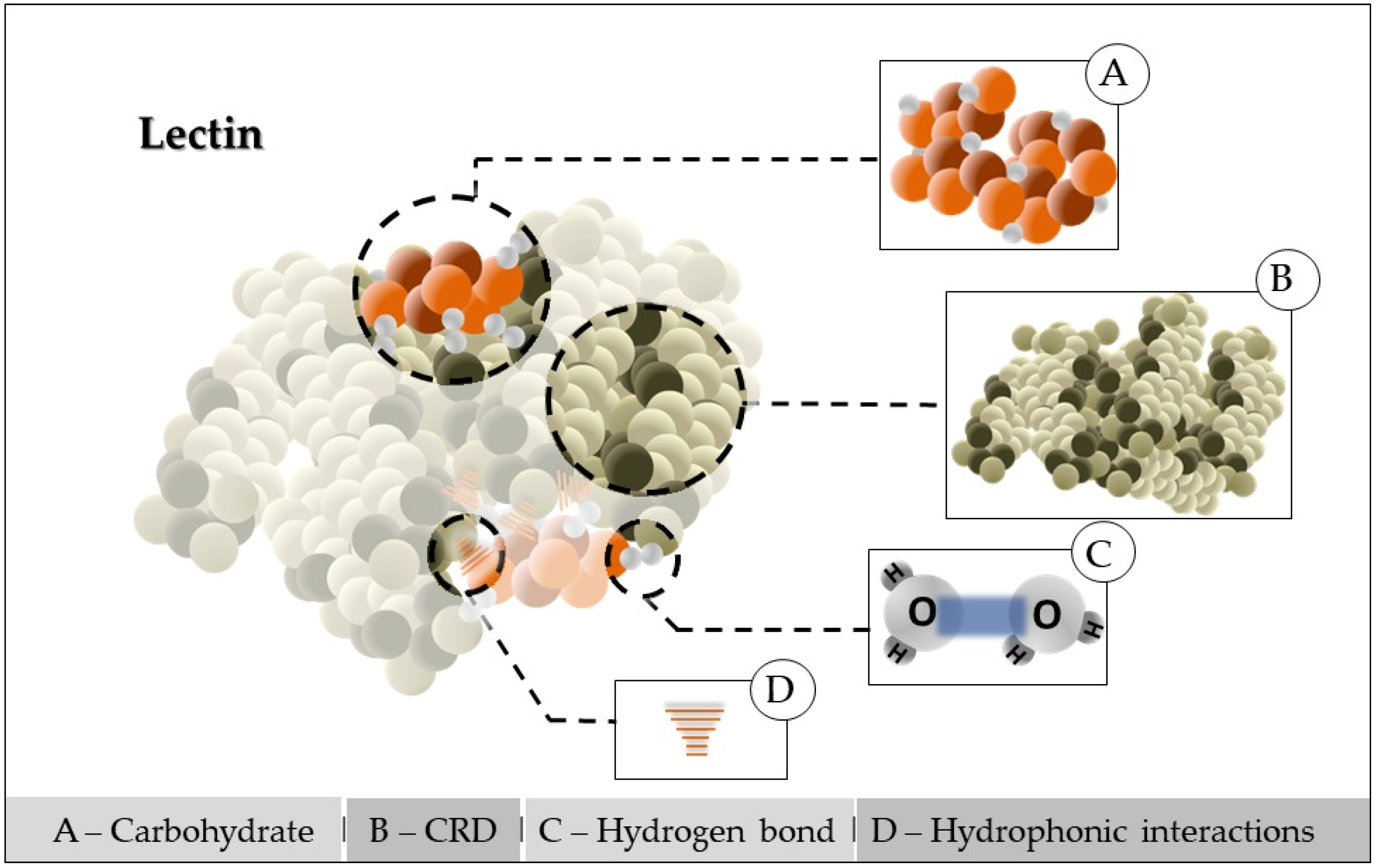
References
- Janson, J.C. Principles, High Resolution Methods, and Applications. In Protein Purification; John Wiley & Sons: Hoboken, NJ, USA, 2011; pp. 3–50. ISBN 978-0-471-74661-4.
- Dainiak, M.B.; Allan, I.U.; Savina, I.N.; Cornelio, L.; James, E.S.; James, S.L.; Mikhalovsky, S.v.; Jungvid, H.; Galaev, I.Y. Gelatin-Fibrinogen Cryogel Dermal Matrices for Wound Repair: Preparation, Optimisation and in Vitro Study. Biomaterials 2010, 31, 67–76.
- Perçin, I.; Khalaf, R.; Brand, B.; Morbidelli, M.; Gezici, O. Strong Cation-Exchange Chromatography of Proteins on a Sulfoalkylated Monolithic Cryogel. J. Chromatogr. A 2015, 1386, 13–21.
- Tao, S.P.; Wang, C.; Sun, Y. Coating of Nanoparticles on Cryogel Surface and Subsequent Double-Modification for Enhanced Ion-Exchange Capacity of Protein. J. Chromatogr. A 2014, 1359, 76–83.
- Ünlüer, Ö.B.; Ersöz, A.; Denizli, A.; Demirel, R.; Say, R. Separation and Purification of Hyaluronic Acid by Embedded Glucuronic Acid Imprinted Polymers into Cryogel. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2013, 934, 46–52.
- Banerjee, S.; Chaki, S.; Bhowal, J.; Chatterjee, B.P. Mucin Binding Mitogenic Lectin from Freshwater Indian Gastropod Belamyia Bengalensis: Purification and Molecular Characterization. Arch. Biochem. Biophys. 2004, 421, 125–134.
- Oliveira, J.T.A.; Melo, V.M.M.; Câmara, M.F.L.; Vasconcelos, I.M.; Beltramini, L.M.; Machado, O.L.T.; Gomes, V.M.; Pereira, S.P.; Fernandes, C.F.; Nunes, E.P.; et al. Purification and Physicochemical Characterization of a Cotyledonary Lectin from Luetzelburgia Auriculata. Phytochemistry 2002, 61, 301–310.
- Roy, I.; Sardar, M.; Gupta, M.N. Cross-Linked Alginate-Guar Gum Beads as Fluidized Bed Affinity Media for Purification of Jacalin. Biochem. Eng. J. 2005, 23, 193–198.
- Gonçalves, G.R.F.; Gandolfi, O.R.R.; Santos, C.M.S.; Bonomo, R.C.F.; Veloso, C.M.; Fontan, R.d.C.I. Development of Supermacroporous Monolithic Adsorbents for Purifying Lectins by Affinity with Sugars. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2016, 1033–1034, 406–412.
- Ourth, D.D.; Rose, W.M. Purification, Characterization and Seasonal Variation of Mannose-Binding C-Type Lectin in Ictalurid Catfish. Aquaculture 2011, 321, 191–196.
- Jung, W.K.; Park, P.J.; Kim, S.K. Purification and Characterization of a New Lectin from the Hard Roe of Skipjack Tuna, Katsuwonus Pelamis. Int. J. Biochem. Cell Biol. 2003, 35, 255–265.
- Arora, S.; Saxena, V.; Ayyar, B.V. Affinity Chromatography: A Versatile Technique for Antibody Purification. Methods 2017, 116, 84–94.
- Mallik, R.; Hage, D.S. Affinity Monolith Chromatography. J. Sep. Sci. 2006, 29, 1686–1704.
- Pfaunmiller, E.L.; Paulemond, M.L.; Dupper, C.M.; Hage, D.S. Affinity Monolith Chromatography: A Review of Principles and Recent Analytical Applications. Anal. Bioanal. Chem. 2013, 405, 2133–2145.
- Ferreira da Silva, J.; Lemos da Silva, D.; Gomes Nascimento, R.; Ayra Alcântara Veríssimo, L.; Martins Veloso, C.; Ferreira Bonomo, R.C.; da Costa Ilhéu Fontan, R. Enhancements in Sugar Immobilization in Polymeric Macroporous Matrices for Affinity Capture. J. Appl. Polym. Sci. 2019, 136, 47956.
- Gondim, A.C.S.; Romero-Canelón, I.; Sousa, E.H.S.; Blindauer, C.A.; Butler, J.S.; Romero, M.J.; Sanchez-Cano, C.; Sousa, B.L.; Chaves, R.P.; Nagano, C.S.; et al. The Potent Anti-Cancer Activity of Dioclea Lasiocarpa Lectin. J. Inorg. Biochem. 2017, 175, 179–189.
- Suzuki, T.; Abe, T.; Umehara, K.; Choi, J.H.; Hirai, H.; Dohra, H.; Kawagishi, H. Purification and Characterization of a Lectin from the Mushroom Hypsizigus Marmoreus. Mycoscience 2015, 56, 359–363.
- Selvaprakash, K.; Chen, Y.C. Functionalized Gold Nanoparticles as Affinity Nanoprobes for Multiple Lectins. Colloids Surf. B Biointerfaces 2018, 162, 60–68.
- Matoba, Y.; Sato, Y.; Oda, K.; Hatori, Y.; Morimoto, K. Lectins Engineered to Favor a Glycan-Binding Conformation Have Enhanced Antiviral Activity. J. Biol. Chem. 2021, 296.
- Gajbhiye, V.; Gong, S. Lectin Functionalized Nanocarriers for Gene Delivery. Biotechnol. Adv. 2013, 31, 552–562.
- He, S.; Shi, J.; Walid, E.; Zhang, H.; Ma, Y.; Xue, S.J. Reverse Micellar Extraction of Lectin from Black Turtle Bean (Phaseolus Vulgaris): Optimisation of Extraction Conditions by Response Surface Methodology. Food Chem. 2015, 166, 93–100.
- Lavín de Juan, L.; García Recio, V.; Jiménez López, P.; Girbés Juan, T.; Cordoba-Diaz, M.; Cordoba-Diaz, D. Pharmaceutical Applications of Lectins. J. Drug Deliv. Sci. Technol. 2017, 42, 126–133.
- Santos, A.L.E.; Júnior, C.P.S.; Neto, R.N.M.; Santos, M.H.C.; Santos, V.F.; Rocha, B.A.M.; Sousa, E.M.; Carvalho, R.C.; Menezes, I.R.A.; Oliveira, M.R.C.; et al. Machaerium Acutifolium Lectin Inhibits Inflammatory Responses through Cytokine Modulation. Proc. Biochem. 2020, 97, 149–157.
- Carrillo, C.; Cordoba-Diaz, D.; Cordoba-Diaz, M.; Girbés, T.; Jiménez, P. Effects of Temperature, PH and Sugar Binding on the Structures of Lectins Ebulin f and SELfd. Food Chem. 2017, 220, 324–330.
- Singh, A.; Trans, K.S.-C.S. Effect of Temperature, PH and Denaturing Agents on Biological Activity of MCJ Lectin. Chem. Sci. Trans. 2013, 2.
- Sharon, N.; Lis, H. Legume Lectins—A Large Family of Homologous Proteins. FASEB J. 1990, 4, 3198–3208.
- Kanellopoulos, P.N.; Tucker, P.A.; Pavlou, K.; Agianian, B.; Hamodrakas, S.J. A Triclinic Crystal Form of the Lectin Concanavalin A. J. Struct. Biol. 1996, 117, 16–23.
